Règles de Baldwin
Les règles de Baldwin en chimie organique sont une série de règles décrivant modes de cyclisation favorables pour les composés alicycliques. Elles ont été proposées pour la première fois par Jack Baldwin en 1976[1] - [2].
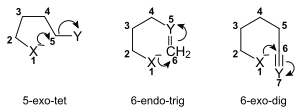
Les règles de Baldwin portent sur les vitesses relatives des différents modes de cyclisation. Elles ne sont pas destinées à décrire la probabilité absolue qu'une réaction se produise ou non, elles sont plutôt utilisées pour donner une probabilité relative. Une réaction défavorisée (lente) n'a pas une vitesse capable de rivaliser efficacement avec une réaction qui est favorisée (rapide). Cependant, le produit défavorisé peut être observé, si aucune réaction alternative n'est plus favorisée.
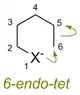
Les règles classent les cyclisations de trois manières :
- le nombre d'atomes dans le cycle nouvellement formé
- en fermetures de cycle exo et endo, selon que la liaison rompue pendant la fermeture de cycle se trouve à l'intérieur ( endo ) ou à l'extérieur ( exo ) de l'anneau en formation
- dans tet, trig et dig géométrie de l'atome étant attaqué, selon que le carbone électrophile est tetraédrique (hybridé sp3), trigonal (hybridé sp2) ou digonal (hybridé sp).
Ainsi, une réaction cyclisation pourrait être classée comme, par exemple, un 5 -exo-trig.
Baldwin a découvert que les exigences de recouvrement orbitalaire pour la formation de liaisons favorisent uniquement certaines combinaisons de taille de cycle et les paramètres exo/endo/dig/trig/tet. Des modèles 3D interactifs de plusieurs de ces états de transition peuvent être consultésici (javascript requis).
Il existe des exceptions aux règles de Baldwin. Par exemple, les cations ne respectent que rarement les règles de Baldwin, tout comme les réactions dans lesquelles un atome de la troisième période est inclus dans le cycle. Une version étendue et révisée des règles est disponible[3]:
| 3 | 4 | 5 | 6 | 7 | ||||||
| type | exo | endo | exo | endo | exo | endo | exo | endo | exo | endo |
| tet | ✓ | ✓ | ✓ | X | ✓ | X | ✓ | X | ||
| trig | ✓ | X | ✓ | X | ✓ | X | ✓ | ✓ | ✓ | ✓ |
| dig | X | ✓ | X | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ |
Les règles s'appliquent lorsque le nucléophile peut attaquer la liaison selon un angle idéal. Ces angles sont de 180° ( inversion de Walden ) pour les réactions exo-tet, de 109° ( angle de Bürgi-Dunitz ) pour la réaction exo-trig et de 120° pour les réactions endo-dig. Les angles d'attaque nucléophile sur les alcynes ont été revus et redéfinis récemment[4]. L'« angle aigu » d'attaque postulé par Baldwin a été remplacé par une trajectoire similaire à l'angle de Bürgi-Dunitz[5].
Applications
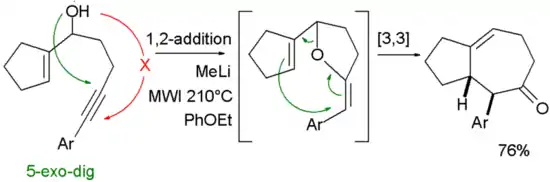
Dans une étude, des cycles à sept chaînons ont été construits dans une réaction d'addition en tandem 5 -exo-dig / réarrangement de Claisen[6]:
Un modèle 6-endo-dig a été observé dans une addition 1,2-tandem allène - alcyne / cyclisation de Nazarov catalysé par un composé d'or[7]:
.png.webp)
Une réaction de fermeture de cycle 5-endo-dig faisait partie d'une synthèse de (+)-Preussin[8]:
Règles pour les énolates
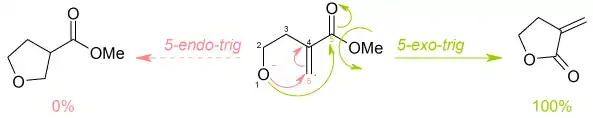
Les règles de Baldwin s'appliquent également aux aldolisations intramoléculares impliquant des énolates[9] - [10]. Deux nouveaux descripteurs doivent être définis : enolendo et enolexo, qui indiquent si les deux carbones du fragment énolate CC sont respectivement incorporés ou non dans le cycle formé.

Les règles sont les suivantes[11]:
| enolendo | enolexo | |||||||||
| type | 3 | 4 | 5 | 6 | 7 | 3 | 4 | 5 | 6 | 7 |
| exo-tet | X | X | X | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ |
| exo-trig | X | X | X | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ |
Exceptions
Ces règles sont basées sur des preuves empiriques et de nombreuses « exceptions » sont connues[12] - [13] - [14]. Les exemples incluent :
Notes et références
- Jack E. Baldwin, « Rules for Ring Closure », J. Chem. Soc., Chem. Commun., no 18, , p. 734–736 (DOI 10.1039/C39760000734)(Open access)
- Baldwin et al., « Rules for Ring Closure: Ring Formation by Conjugate Addition of Oxygen Nucleophiles », J. Org. Chem., vol. 42, no 24, , p. 3846 (DOI 10.1021/jo00444a011)
- The Baldwin Rules: Revised and Extended. Gilmore, K; Mohamed, R. K.; Alabugin, I. V. WIREs: Comput. Mol. Sci. 2016, 6, 487–514. http://wires.wiley.com/WileyCDA/WiresArticle/wisId-WCMS1261.html DOI 10.1002/wcms.1261
- Gilmore, K.; Alabugin,I. V. Cyclizations of Alkynes: Revisiting Baldwin's Rules for Ring Closure. Chem. Rev. 2011. 111, 6513–6556. DOI 10.1021/cr200164y
- Alabugin, I. Gilmore, K.;Manoharan, M. Rules for Anionic and Radical Ring Closure of Alkynes. J. Am. Chem.Soc. 2011, 133, 12608-12623, DOI 10.1021/ja203191f
- Li, X.; Kyne, R. E.; Ovaska, T. V. Synthesis of Seven-Membered Carbocyclic Rings via a Microwave-Assisted Tandem Oxyanionic 5-exo dig Cyclization−Claisen Rearrangement Process, J. Org. Chem., 2007, 72, 6624 DOI 10.1021/jo0710432
- Guan-You Lin, Chun-Yao Yang, and Rai-Shung Liu. Gold-Catalyzed Synthesis of Bicyclo[4.3.0]nonadiene Derivatives via Tandem 6-endo-dig/Nazarov Cyclization of 1,6-Allenynes J. Org. Chem. 2007, 72, 6753-6757 DOI 10.1021/jo0707939
- Overhand et Hecht, « A Concise Synthesis of the Antifungal Agent (+)-Preussin », Journal of Organic Chemistry, vol. 59, no 17, , p. 4721–4722 (DOI 10.1021/jo00096a007)
- Baldwin et Kruse, « Rules for ring closure. Stereoelectronic control in the endocyclic alkylation of ketone enolates », Journal of the Chemical Society, Chemical Communications, no 7, , p. 233 (DOI 10.1039/C39770000233)
- Baldwin, « Rules for ring closure: application to intramolecular aldol condensations in polyketonic substrates », Tetrahedron, vol. 38, no 19, , p. 2939–2947 (DOI 10.1016/0040-4020(82)85023-0)
- M. B. Smith, J. March, March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 6th ed., Wiley-Interscience, 2007, (ISBN 978-0-471-72091-1)
- J. Clayden, N. Greeves, S. Warren, Organic Chemistry, 2nd ed., OUP Oxford, 2012, (ISBN 978-0199270293)
- J. E. Baldwin, J. Cutting, W. Dupont, L. Kruse, L. Silberman, R. C. Thomas. J. Chem. Soc., Chem. Commun., 1976, 736-738. DOI 10.1039/C39760000736
- Finding the right path: Baldwin "Rules for Ring Closure" and stereoelectronic control of cyclizations. Alabugin, I. V.; Gilmore, K. Chem. Commun., 2013, 49, 11246 – 11250. http://pubs.rsc.org/en/content/articlehtml/2013/cc/c3cc43872d