Collagène
Le collagène est une protéine structurale, le plus souvent présente sous forme fibrillaire. Biopolymère constitué par des triples chaînes polypeptidiques enroulées en triple hélice, il est présent dans la matrice extracellulaire des organismes animaux. Ces protéines ont pour fonction de conférer aux tissus une résistance mécanique à l'étirement.

C'est la protéine la plus abondante du règne animal, représentant le quart environ de la masse protéique des mammifères. Il est présent dans les os, le cartilage, l'interstitium pulmonaire, les muscles et les parois des vaisseaux. Sécrété par les cellules des tissus conjonctifs, il a une masse moléculaire de 300 kDa.
Contrairement à l’élastine aussi présente dans les tissus conjonctifs, le collagène est inextensible et résiste bien à la traction. Il existe différents types de collagène selon l'organe considéré. Il est notamment indispensable à la cicatrisation.
Le collagène est la matière première de la production de gélatine.
Une protéine structurale
Les biochimistes connaissent plus de 100 000 protéines. Ces molécules interviennent dans de nombreux processus. Certaines sont au cœur de l’immunologie. D’autres ont une activité enzymatique indispensable au fonctionnement de la machinerie cellulaire. D’autres encore forment les récepteurs membranaires par lesquels les cellules interagissent avec le milieu environnant. Quelques-unes, enfin, participent à la structuration des organismes.
Une molécule très abondante
Les protéines sont de deux types. Les protéines fonctionnelles interviennent dans des processus biochimiques (enzymologie, immunologie, récepteurs membranaires, etc.). Les protéines structurales déterminent les organismes en contribuant à leur structure. Parmi celles-ci, le collagène est particulièrement abondant. Chez les mammifères, elle représente un quart de leurs protéines, soit environ 25 % de leur masse.
Typologie
Le collagène est une protéine composée de trois chaînes alpha polypeptidiques, reliées par des liaisons hydrogène entre l'hydroxylysine et l'hydroxyproline et des liaisons covalentes. Une chaîne alpha est constituée de 1 055 acides aminés. Pouvant se combiner de différentes manières, on devrait en toute rigueur parler des collagènes, et non du collagène. Chaque type de collagène possède une structure propre et se retrouve dans des organes particuliers. Par exemple, le collagène de type I intervient dans la formation de la peau, des tendons, des os et de la cornée, tandis que le type III se retrouve au niveau du système cardiovasculaire.
| Type | Description | Gène (s) | Troubles |
| I | 90 % du collagène d’un vertébré. Il constitue la trame de l’os (à comparer aux armatures du béton armé), et plus généralement des tissus conjonctifs banals. Il se trouve dans les os, la peau, les tendons, la cornée et les organes internes. | COL1A1, COL1A2 | Ostéogenèse imparfaite, syndrome d'Ehlers-Danlos |
| II | Forme de fines fibrilles dans la substance fondamentale du cartilage hyalin (avec les collagènes IX, X et XI) dans le nucléus pulposus du disque intervertébral et dans le corps vitré de l’œil. | COL2A1 | - |
| III | Il est constitutif des fibres de réticuline trouvées en proportion importante dans les tissus hématopoïétiques. À l’état de collagène, il se trouve en particulier dans le muscle squelettique et dans la paroi des vaisseaux sanguins. Les fibres sont argyrophiles et PAS positives | COL3A1 | Syndrome d'Ehlers-Danlos, maladie de Dupuytren |
| IV | Spécifique des lames basales, il constitue un réseau plan ou 3D. Il n'est pas strié en microscopie électronique. Il peut grâce à sa structure avoir une fonction de filtration notamment au niveau des reins. | COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6 | Néphropathies par anomalie du collagène IV, syndrome de Goodpasture |
| V | Localisé dans les tissus conjonctifs, il s’associe au type I | COL5A1, COL5A2, COL5A3 | Syndrome d'Ehlers-Danlos |
| VI | Localisé dans les tissus conjonctifs, il s’associe au type I | COL6A1, COL6A2, COL6A3 | Myopathie de Bethlem, dermatite atopique |
| VII | Constituant de la lame basale. Il forme des fibrilles permettant l’accrochage de la lame basale au tissu conjonctif sous-jacent. | COL7A1 | Épidermolyse bulleuse dystrophique |
| VIII | Localisé dans les cellules endothéliales. | COL8A1, COL8A2 | Dystrophie cornéenne postérieure polymorphe |
| IX | Localisé dans le cartilage, s’associe au collagène de type II | COL9A1, COL9A2, COL9A3 | Dysplasies polyépiphysaires |
| X | Localisé dans le cartilage hypertrophié et minéralisé. | COL10A1 | - |
| XI | Localisé dans le cartilage. | COL11A1, COL11A2 | - |
| XII | Interagit avec les types I et III. | COL12A1 | - |
| XIII | - | COL13A1 | - |
| XIV | - | COL14A1 | - |
| XV | Disséminés ; près de la lame basale des muscles. | COL15A1 | - |
| XVI | - | COL16A1 | - |
| XVII | Également appelé BPAG2, c’est une protéine transmembranaire qui se fixe à la lame basale d’hémidesmosomes, au niveau de l’épiderme notamment. Les fibres de collagène de type XVII sont disposées parallèlement aux intégrines α6β4. Ces deux protéines permettent donc de renforcer l’ancrage de la lame basale. | COL17A1 | Pemphigoïde bulleuse |
| XVIII | Collagène de « jonction d'ancrage ». C'est l'un des collagènes retrouvés au niveau de la couche fibrillaire des membranes basales. Précurseur de l endostatine, lorsqu'on clive la partie C-Terminal | COL18A1 | - |
| XIX | - | COL19A1 | - |
| XX | - | COL20A1 | - |
| XXI | - | COL21A1 | - |
| XXII | - | COL22A1 | - |
| XXIII | - | COL23A1 | - |
| XXIV | - | COL24A1 | - |
| XXV | - | COL25A1 | - |
| XXVI | Les recherches sur le collagène 26 doivent être approfondies. À l'heure actuelle il ne rentre dans aucune des familles de collagène[1] - [2] | COL26A1 | |
| XXVII | - | COL27A1 | - |
| XXVIII | Ressemble étroitement au type VI. | COL28A1 | - |
Une colle naturelle
Lorsque le collagène est partiellement hydrolysé, les trois brins de tropocollagène se dissocient. Ils forment ainsi la gélatine, un produit largement utilisé dans l’agroalimentaire. La gélatine a aussi été utilisée dans l’industrie pharmaceutique, en cosmétique et en photographie. Le collagène et la gélatine sont considérés comme des protéines de piètre qualité nutritionnelle car ils ne possèdent pas tous les acides aminés en proportions adéquates.
Le terme collagène signifie « producteur de colle » (le nom vient du mot grec kolla signifiant « colle »). Les propriétés du collagène ont été utilisées par les Égyptiens 2 000 ans av. J.-C. Les Amérindiens l’utilisaient au Ve siècle. La plus ancienne colle connue est faite à partir de collagène, et date de 6 000 ans av. J.-C. Au début du XXIe siècle, il est utilisé dans les produits de beautés ou comme additif dans certains aliments.
Tropocollagène
Le tropocollagène est l'unité fondamentale du collagène, et correspond à une molécule asymétrique de 280 nm de long et de 1,5 nm de diamètre. Il s'agit d'une glycoprotéine formée par l'enroulement de trois hélices gauches α, porteuses de glucide (glucose, galactose), superenroulées en hélice droite. Les acides aminés sont constitués pour un tiers de glycine, pour un quart de proline, d'hydroxylysine et de 4-hydroxyproline. Il existe plusieurs types moléculaires de chaînes α. Ces chaînes sont constituées par des séquences répétitives de trois acides aminés, dont le premier, la glycine est répétée tout au long de la molécule. Les glucides sont fixés sur l'hydroxylysine. L'enroulement des trois chaînes α aboutit à la constitution de la molécule de tropocollagène, dont la cohésion est assurée par des liaisons hydrogène entre la glycine et l'hydroxyproline.
Acides aminés particuliers
.jpg.webp)
.jpg.webp)
L’analyse de la composition d’une molécule de tropocollagène révèle de nombreuses singularités. Les biochimistes ont montré que le tiers des résidus sont des résidus de glycine, ce qui est caractéristique des protéines de structure. Autre fait singulier, plus de 10 % des résidus sont des prolines. Enfin, on observe la présence de deux acides aminés peu courants, la 4-hydroxyproline (Hyp) et la 5-hydroxylysine (Hyl).
Une séquence particulière
Les biochimistes ont également constaté que l’ordre d’enchaînement des acides aminés qui composent le tropocollagène présente aussi des anomalies. En d’autres termes, la séquence d’acides aminés ne correspond pas à ce que l’on rencontre habituellement. On observe en effet que les glycines se retrouvent régulièrement tous les trois résidus. La structure de la séquence des acides aminés du collagène est donc (Gly – X – Y)n. De plus, la séquence comporte assez souvent des triplets Gly – Pro – Hyp. Toutes ces propriétés sont singulières dans la mesure où elles ne se retrouvent pas chez la plupart des protéines.
Complément alimentaire
Le collagène peut avoir différentes origines : bovine, porcine, aviaire ou marine. C'est généralement la peau qui sert à la fabrication du collagène utilisé dans les compléments alimentaires. Après avoir subi une hydrolyse, le collagène est décomposé en sous fractions protéiques dénommées peptides. Ces peptides sont eux-mêmes constitués de plusieurs acides aminés. Les peptides de collagène sont très utilisés par l'industrie pharmaceutique pour créer des compléments alimentaires dont l'objectif est généralement la régénération des tissus conjonctifs et les bienfaits sur la peau, les ongles, les cheveux. Les sportifs utilisent notamment les peptides de collagène de type I afin de prévenir les tendinites dues à la pratique sportive intensive.
Les peptides de collagène marin sont hydrolysés spécialement pour garantir ces propriétés fonctionnelles. En outre, l'origine des peptides de collagène à base de poissons est appréciée sur tous les continents.
Hydroxylation et glycosylation
Hydroxylation
Les deux acides aminés hydroxylés que sont l’hydroxyproline (Hyp) et l’hydroxylysine (Hyl) soulèvent tout naturellement une question : l’hydroxylation intervient-elle avant ou après la synthèse peptidique ? Pour y répondre, les biochimistes ont recherché un aminoacyl-ARNt codant l’un ou l’autre de ces acides aminés. N’en ayant pas trouvé, ils ont conclu que l’hydroxylation de certains résidus de proline et de lysine est un processus post-traductionnel. En fait, deux enzymes catalysent cette réaction. Ce sont respectivement la prolyl hydroxylase et la lysine hydroxylase. Toutes deux ne peuvent agir qu’en présence d’ascorbate (ou vitamine C), celui-ci empêchant le fer ferreux (Fe2+) contenu dans leur centre actif d’être inactivé sous forme de fer ferrique (Fe3+). Une carence sévère en ascorbate est à l’origine du scorbut, une maladie due à un défaut de fabrication du collagène, lequel se traduit par une fragilisation des tissus. Le scorbut a sévi sur terre et sur mer jusqu'au XIXe siècle. Les marins, lors des grands voyages, en étaient souvent victimes, faute de pouvoir consommer des fruits et des légumes.
Les résidus de proline susceptibles d’être hydroxylés sont nécessairement situés à gauche d’un résidu de glycine. Les autres résidus ne peuvent être hydroxylés. Il en va de même pour les résidus de lysine.
(extrémité aminoterminale) NH3+ – … – Pro – Gly – … – COO− (extrémité carboxyterminale)
(extrémité aminoterminale) NH3+ – … – Lys – Gly – … – COO− (extrémité carboxyterminale)
Très rarement, certains résidus de proline sont hydroxylés au niveau du carbone 3 et non du carbone 4. L’enzyme responsable de cette hydroxylation n’est pas la prolylhydroxylase, et l’hydroxylation ne respecte pas les règles que nous venons de définir.
Glycosylation
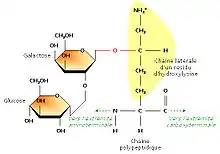
En étudiant la structure du tropocollagène, les biochimistes ont également montré que certains résidus d’hydroxylysine possédaient des résidus sucrés (2-glucosyl-galactose). Le fait que le collagène soit lié de façon covalente à de courts glucides en fait une glycoprotéine (par opposition aux protéoglycanes, glucides liés à de petits peptides). La formation d’une liaison covalente entre le galactose et le groupement hydroxyle d’un résidu hydroxylysine est catalysée par la galactosyl transférase ; celle du glucose fait appel à la glucosyl transférase.
Structure secondaire
Un cylindre hélicoïdal
La conformation spatiale du tropocollagène est celle d’un cylindre hélicoïdal à trois bandes de 300 nm de long et de 1,5 nm de diamètre. Cette protéine ne présente donc pas la forme globulaire classique des protéines fonctionnelles. C’est une tige longue et fine. Chaque bande du cylindre est une chaîne polypeptidique elle-même repliée en hélice ; l’ensemble des trois chaînes forme une tresse particulièrement résistante. En effet, il faut une charge de 10 kg pour casser une fibre de collagène d’un diamètre d’un millimètre.
Structure en hélice gauche
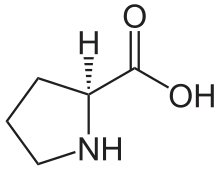
Nous avons dit que chaque chaîne polypeptidique est repliée en hélice. Cette structure secondaire est sans rapport avec l’hélice alpha. Il s’agit d’un autre type de structure secondaire. Il s’agit ici d’une hélice gauche dont l’enroulement résulte de la répulsion des cycles pyrrolidines des nombreux résidus de proline. Les cycles pyrrolidines se repoussent mutuellement en raison de leur fort encombrement stérique. L’hélice obtenue est moins compacte que l’hélice alpha (0,15 nm par résidu) puisque l’on a pu mesurer une distance de 0,29 nm par résidu. Enfin, contrairement aux hélices alpha, on n’observe pas de ponts hydrogène intracaténaires. On trouve néanmoins des ponts hydrogène intercaténaires. Les ponts hydrogène mettent en jeu les résidus de glycine (donneurs de protons) et les groupements carboxyle (accepteurs de protons). Lorsque les chaînes se croisent, il est nécessaire de réduire l’encombrement stérique. Ceci est rendu possible par la présence de résidus de glycine, l’acide aminé le moins encombré. Les autres chaînes latérales sont rejetées à l’extérieur de la structure en triple hélice.
Interactions coopératives
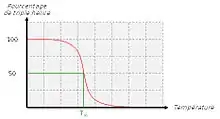
Lorsque l’on chauffe une solution de tropocollagène, on observe un effondrement brusque de la structure en hélice à une température donnée, notée Tm (température de fusion ou melting temperature dans la terminologie anglo-saxonne). Cette expérience montre que les ponts hydrogène assurent le maintien de la structure en triple hélice. Ces interactions faibles (c’est-à-dire non covalentes) sont suffisamment nombreuses pour modifier sensiblement le comportement de la molécule. On ne doit pas s’en étonner : la fibroïne, protéine structurale de la soie fabriquée par les araignées, doit son élasticité et sa résistance à l’existence de très nombreux ponts hydrogène qui constituent des interactions coopératives. De la même façon, les propriétés singulières de l’eau, en particulier son point d’ébullition « anormalement » élevé, sont la conséquence directe de l’existence de nombreux ponts hydrogène. La mesure de la température de fusion Tm est rendue possible par le fait qu’elle marque un changement de viscosité de la solution et une modification de la dispersion rotatoire optique (DRO).
Importance des hydroxylations
Les hydroxylations observées sur le collagène offrent un gain de stabilité. Leur nombre varie donc en fonction du type de tissu et de la température corporelle. Certains tissus présentent un plus fort taux d’hydroxylation que d’autres. C’est notamment le cas du placenta et de la peau.
| Pro et Hyp (‰) | Température de fusion (°C) | Température corporelle (°C) | |
| Peau de veau | 232 | 39 | 37 |
| Peau de requin | 191 | 29 | 24 à 28 |
| Cabillaud | 155 | 16 | 10 à 14 |
Biosynthèse
.jpg.webp)
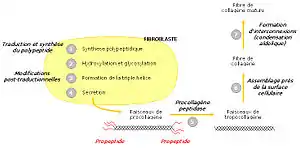
Procollagène
Le collagène n’a pas sa place dans les cellules elles-mêmes ; c’est pourquoi sa synthèse s’effectue à partir d’un précurseur présent dans les cellules, le procollagène. Celui-ci est constitué de brins beaucoup plus longs, rallongés par des structures polypeptidiques supplémentaires, de 15 kDa du côté aminoterminal et de 30 kDa du côté carboxyterminal. Ces structures sont banales et portent le nom de propeptides. À l’extrémité carboxy-terminale existent des ponts disulfure intercaténaires à rôle stabilisateur. Les ponts sont intracaténaires à l’extrémité aminoterminale.
Tropocollagène
Le tropocollagène est un assemblage de trois protéines de collagène alpha (alpha1 - alpha1 - alpha2) en une hélice droite. Les fibres de tropocollagène s'assemblent en une structure appelée fibrille de collagène. L'assemblage de plusieurs fibrilles de collagène forme la fibre de collagène. Les fibrilles présentent une alternance de phase sombre et claire due a l'espacement et au décalage des fibres de procollagène.
Dans le réticulum endoplasmique
Les trois chaînes de procollagène sont synthétisées transférées dans le lumen du réticulum endoplasmique (on parle de translocation). La région contenant la triple hélice est flanquée d’un peptide signal et de deux propeptides aminoterminal et carboxyterminal. Ceux-ci aident à la maturation de la protéine.
Modifications post-traductionnelles
Une fois dans le réticulum endoplasmique, le peptide signal est clivé. Ensuite intervient l’hydroxylation de plusieurs prolines et lysines. Le propeptide carboxyterminal est modifié par N-glycosylation, tandis que certaines hydroxylysines sont O-glycosylées. Les différentes modifications post-traductionnelles et la formation de ponts disulfure entre les propeptides carboxyterminaux de trois chaînes permettent ensuite leur alignement. La triple hélice s’enroule alors comme une fermeture éclair, en direction de l’extrémité aminoterminale.
Dans l'appareil de Golgi
Enfin, dans l’appareil de Golgi, la triple hélice est flanquée de régions non hélicales. Le procollagène est alors libéré dans le milieu extracellulaire par exocytose. Une enzyme, la procollagène peptidase, clive alors les deux propeptides, permettant la formation de tropocollagène mature. En tout dernier lieu, les faisceaux de tropocollagène s’assemblent à proximité de la surface cellulaire, s’interconnectent et forment des fibres de collagène matures.
Formation des fibres de collagène
.svg.png.webp)
Pour former des fibres de collagène matures, les faisceaux de tropocollagène doivent s’assembler. Divers processus biochimiques y conduisent. Par exemple, une enzyme, la lysyl oxydase, permet la substitution d’un groupement carbonyle au groupement amine d’un résidu lysine, ce qui est à l’origine de pontages spontanés en plusieurs faisceaux de tropocollagène. On procède ainsi à une réticulation des molécules par condensation aldolique.
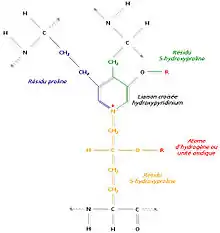
Un autre mécanisme consiste à relier trois régions polypeptidiques par une liaison croisée hydroxypyridinium (ou hydroxypyridinoline). Il se forme alors une structure en échelle qui présente une périodicité de 680 Å, visible en microscopie électronique. Les zones inoccupées entre les différentes molécules de tropocollagène sont remplies à l’aide d’un hydroxyphosphate de calcium, l’hydroxyapatite, de formule Ca10 (PO4)6 (OH)2. La succession régulière de tropocollagène et d’hydroxyapatite est à l’origine de la striation visible en microscopie électronique.
Dégradation
Collagénases
La dégradation du collagène est difficile et nécessite des enzymes particulières, les collagénases (de la famille des métalloprotéinases matricielles). Par exemple, les collagénases d’origine bactérienne (par exemple Clostridium histoliticum, dont le nom d’espèce signifie « destructeur de tissus ») sont capables de cliver chaque chaîne de collagène en plus de deux cents points (parmi lesquels X – Gly – Pro – Y). D’autres organismes tels que les amphibiens possèdent des collagénases très spécifiques, capables d’effectuer une seule coupure à un site défini.
Maladies liées au collagène
Outre le scorbut dû à une carence en vitamine C (voir la section hydroxylation) de nombreuses maladies sont liées à des défauts de synthèse du collagène, parmi lesquelles la maladie des os de verre.
Dans le syndrome d'Ehlers-Danlos, le collagène est déficient[3].
Usages biomédicaux
Notamment parce que considéré comme ne présentant que de très faibles risques allergiques, le collagène a de nombreux usages biomédicaux et paramédicaux[4]. On le trouve notamment dans certaines éponges hémostatiques résorbables.
Usages cosmétiques
Le collagène de type I natif et soluble est maintenant aussi utilisé dans la cosmétique dans le monde entier.
Substituts du collagène
Le collagène étant une protéine animale, par essence, il ne peut pas être étiqueté végan, car le véganisme vise à s'abstenir de toute utilisation de produits d'origine animale. Tel quel, le terme « collagène végan » n'a pas de sens et est donc trompeur.
Cependant, depuis une trentaine d'années, des tentatives ont été entreprises en laboratoire à petite échelle pour produire du collagène humain recombinant à partir de divers organismes génétiquement modifiés comme des levures (Pichia pastoris), des bactéries (Escherichia coli), et même des insectes avec différents succès[5] - [6] - [7] - [8] - [9]. Des modifications post-traductionnelles insuffisantes et un faible rendement restent des problèmes non résolus[10].
Des articles de revue (Fertala, 2020[11] et Wang et al., 2017[10]), il ressort que ces techniques de production de collagène humain recombinant ne sont pas largement reconnues, ni adoptées, par le monde médical, pharmaceutique et des biotechnologies. Des obstacles techniques et réglementaires non résolus expliquent que la production du collagène se fait toujours majoritairement à partir de tissus d'origine animale.
Malgré cela l'appellation « collagène végan » est employée dans certaines campagnes publicitaires pour des cosmétiques et produits de beauté sans savoir à quoi font exactement référence ces produits et si cette expression est abusive ou non.
Beaux-arts

Grâce aux coordonnées atomiques enregistrées dans la banque de données sur les protéines Protein Data Bank (PDB), l’artiste germano-américain Julian Voss-Andreae a réalisé des sculptures basées sur la structure du collagène et d’autres protéines[12]. Dans l’œuvre Unraveling Collagen, les formes triangulaires révèlent les lignes de force dominantes évoquant les constructions contemporaines en acier[13] - [14].
Biomimétisme
La résistance mécanique, la flexibilité du collagène (environ 30% des protéines du corps humain) intéresse le secteur des nanotechnologies et ceux qui cherchent à créer des membranes polymères piézoélectriques souples pour un usage biomédical[15] - [16], mais cette protéine est « grande et complexe »[17].
Une des caractéristiques du collagène naturel est que, comme la cellulose et la chitine (par exemple extraite des carapaces de crevettes)[18], c'est un matériau légèrement piézoélectrique, mais pas assez pour que l'électricité produite puisse être exploité[19] - [20]. Selon Ehud Gazit de l'Université de Tel-Aviv[21] il fallait pour cela trouver ou créer une molécule plus petite, plus simple et plus courte, mais imitant le collagène et ses propriétés[17]. Selon un article publié dans la revue Nature Materials, il a réussi, avec une équipe internationale de recherche à faire produire un courant électrique « sain » par un matériau biosinpiré du collagène : un tripeptide à molécule très courte (quelques centaines de nanomètres), baptisée Hyp-Phe-Phe, fait de trois acides aminés auto-assemblés en une forme d'hélice semblable à celle du collagène, flexible et aussi résistant que le titane, pouvant générer un courant électrique y compris dans le corps humain, via l’activation naturelle des muscles (effet activé par la force mécanique) ; ce matériau peut créer un courant et une tension électriques quand il est soumis à une contrainte mécanique[17]. Et inversement, il peut être déformé quand on lui applique un champ électrique ; de quoi imaginer des nanomoteurs ou des nanogénérateurs d'électricité d'un genre nouveau. Un stimulateur cardiaque, par exemple, pourrait ainsi être alimenté en électricité d'origine piezo-électrique, générée via les battements du cœur. Étonnamment cette piézoélectricité est parmi les plus élevées jamais découvertes, dépassant celle des matériaux piézoélectriques du marché qui en outre sont contiennent généralement du plomb toxique[17] (sous forme de titano-zirconate de plomb)[22]. Selon ces chercheurs, dans de nombreux cas où une énergie fatale mécanique est produite (quand on bouge, qu'on mâche, que l'intestin fonctionne, que le coeur bat...) de l'électricité peut être produite, dans le corps humain ; mais aussi à l'extérieur, par exemple par la pression d'une voiture roulant sur des capteurs piezzoélectriques pourrait alimenter l'éclairage d'une rue à son passage. Les matériaux piézoélectriques aujourd'hui polluant (à base de plomb très souvent) pourraient être remplacé par cette molécule biodégradable[17].
En 2018, une étude avait montré que dans l'os, sa partie céramique (hydroxyapatite, minérale) génère au moment d'une microfracture osseuse encore plus d’électricité que le collagène (momentanément assez pour éclairer une ampoule électrique). Le champ électrique ainsi produit est assez puissant pour tuer les cellules proches qui vont alors libérer dans l'organisme des substances chimiques qui vont attirer les cellules responsables de la réparation des microfractures. Des prothèses intégrant des matériaux à flexoélectricité similaire à celle des os pourraient être mieux et plus durablement acceptées par le corps humain[23].
Notes et références
- (en) N. G. Kjeld et M. A. Karsdal, « Chapter 26 - Type XXVI Collagen », dans Biochemistry of Collagens, Laminins and Elastin, Academic Press, (ISBN 978-0-12-809847-9, lire en ligne), p. 151–153
- (en) Keiji Sato, Kentaro Yomogida, Takayuki Wada et Tetuya Yorihuzi, « Type XXVI collagen, a new member of the collagen family, is specifically expressed in the testis and ovary », The Journal of Biological Chemistry, vol. 277, no 40, , p. 37678–37684 (ISSN 0021-9258, PMID 12145293, DOI 10.1074/jbc.M205347200, lire en ligne, consulté le )
- Lire en ligne.
- Lee, C. H., Singla, A. et Lee, Y., Biomedical applications of collagen, International Journal of Pharmaceutics, 2001, 221(1), 1-22.
- (en) N. J. Bulleid, D. C. A. John et K. E. Kadler, « Recombinant expression systems for the production of collagen », Biochemical Society Transactions, vol. 28, no 4, , p. 350–353 (ISSN 0300-5127, DOI 10.1042/bst0280350, lire en ligne, consulté le )
- (en) Minna Nokelainen, Hongmin Tu, Annamari Vuorela, Holger Notbohm, Kari I. Kivirikko et Johanna Myllyharju, « High-level production of human type I collagen in the yeast Pichia pastoris », Yeast, vol. 18, no 9, , p. 797–806 (ISSN 1097-0061, DOI 10.1002/yea.730, lire en ligne, consulté le )
- (en) Outi Pakkanen, Asta Pirskanen et Johanna Myllyharju, « Selective expression of nonsecreted triple-helical and secreted single-chain recombinant collagen fragments in the yeast Pichia pastoris », Journal of Biotechnology, vol. 123, no 2, , p. 248–256 (ISSN 0168-1656, DOI 10.1016/j.jbiotec.2005.11.012, lire en ligne, consulté le )
- (en) Chi Zhang, Daidi Fan, Long'an Shang, Xiaoxuan Ma, Yan'e Luo, Wenjiao Xue et Pengfei Gao, « Optimization of fermentation process for human-like collagen production of recombinant escherichia coli using response surface methodology », Chinese Journal of Chemical Engineering, vol. 18, no 1, , p. 137–142 (ISSN 1004-9541, DOI 10.1016/S1004-9541(08)60334-1, lire en ligne, consulté le )
- (en) Bo An, David L. Kaplan et Barbara Brodsky, « Engineered recombinant bacterial collagen as an alternative collagen-based biomaterial for tissue engineering », Frontiers in Chemistry, vol. 2, , p. 40 (ISSN 2296-2646, DOI 10.3389/fchem.2014.00040, lire en ligne, consulté le )
- (en) Tianyi Wang, Jiewei Lew, Jayaraman Premkumar, Chueh Loo Poh et May Win Naing, « Production of recombinant collagen: state of the art and challenges », Engineering Biology, vol. 1, no 1, , p. 18–23 (ISSN 2398-6182, DOI 10.1049/enb.2017.0003, lire en ligne, consulté le )
- (en) Andrzej Fertala, « Three decades of research on recombinant collagens: reinventing the wheel or developing new biomedical products? », Bioengineering, vol. 7, no 4, , p. 155 (DOI 10.3390/bioengineering7040155, lire en ligne, consulté le )
- (en) « PDB Community Focus: Julian Voss-Andreae, Protein Sculptor », Protein Data Bank Newsletter, no 32, (lire en ligne)
- (en) Barbara Ward, « 'Unraveling Collagen' structure to be installed in Orange Memorial Park Sculpture Garden », Expert Rev. Proteomics, vol. 3 (2), no 2, , p. 174 (DOI 10.1586/14789450.3.2.169, lire en ligne)
- Interview with J. Voss-Andreae, Seeing Below the Surface, Seed Magazine.
- Camille Thevenot, « Élaboration de membranes polymères piézoélectriques souples en vue d’applications biomédicales », sur tel.archives-ouvertes.fr (consulté le )
- Michel Fontanille et Yves Gnanou, « 13. Rhéologie, élaboration et mise en forme des polymères »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Dunod, (consulté le ), p. 415–438
- Administrator, « Une nouvelle nanotechnologie de l'Université de Tel-Aviv produit un courant électrique « sain » à partir du corps humain lui-même », sur ami-universite-telaviv.com (consulté le )
- (en) Sujoy Kumar Ghosh et Dipankar Mandal, « Bio-assembled, piezoelectric prawn shell made self-powered wearable sensor for non-invasive physiological signal monitoring », Applied Physics Letters, vol. 110, no 12, , p. 123701 (ISSN 0003-6951 et 1077-3118, DOI 10.1063/1.4979081, lire en ligne, consulté le )
- (en) C. Halperin, S. Mutchnik, A. Agronin et M. Molotskii, « Piezoelectric Effect in Human Bones Studied in Nanometer Scale », Nano Letters, vol. 4, no 7, , p. 1253–1256 (ISSN 1530-6984 et 1530-6992, DOI 10.1021/nl049453i, lire en ligne, consulté le )
- E. Fukada, « History and recent progress in piezoelectric polymers », IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control, vol. 47, no 6, , p. 1277–1290 (ISSN 0885-3010, DOI 10.1109/58.883516, lire en ligne, consulté le )
- Ecole de biomédecine et de recherche sur le cancer et du Département des sciences et l'ingénierie des matériaux de l’Université de Tel-Aviv, en collaboration avec l'Institut Weizmann et d'autres instituts de recherche en Irlande, en Chine et en Australie,
- (en) Canan Dagdeviren, Yewang Su, Pauline Joe et Raissa Yona, « Conformable amplified lead zirconate titanate sensors with enhanced piezoelectric response for cutaneous pressure monitoring », Nature Communications, vol. 5, no 1, , p. 4496 (ISSN 2041-1723, DOI 10.1038/ncomms5496, lire en ligne, consulté le )
- « Des chercheurs découvrent un moyen de déclencher le processus de réparation osseuse », sur www.esanum.fr (consulté le )
Liens externes
- Ressources relatives à la santé :
- FMA
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :