Chlorure de gadolinium(III)
Le chlorure de gadolinium(III), également connu sous le nom de trichlorure de gadolinium, a pour formule brute GdCl3. Il se présente sous la forme d'un solide incolore, hygroscopique et soluble dans l'eau. On le trouve communément sous sa forme hexahydratée GdCl3∙6H2O, également nommée trichlorure de gadolinium. L'intérêt particulier que l'on porte à cet élément chimique provient du fait que son ion Gd3+ possède le nombre maximal de spins non appariés parmi les espèces connues à ce jour. En effet, il possède sept électrons de valence et ses sept orbitales f sont disponibles, d'où la possibilité pour tous ces électrons d'occuper seuls une orbitale en étant non appariés. La forte symétrie et le magnétisme important de cet ion Gd3+ en font un produit très utile pour des caractérisations en RMN et en IRM.
| Chlorure de gadolinium(III) | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.338 |
| PubChem | 61486 |
| ChEBI | 37288 |
| SMILES | |
| InChI | |
| Apparence | solide incolore, hygroscopique |
| Propriétés chimiques | |
| Formule | GdCl3 |
| Masse molaire[1] | 263,61 ± 0,04 g/mol Cl 40,35 %, Gd 59,65 %, |
| Propriétés physiques | |
| T° fusion | 609 °C |
| T° ébullition | 1 580 °C |
| Solubilité | soluble dans l'eau |
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation
GdCl3 est préparé conventionnellement en phase solide à partir de chlorure d'ammonium, ce qui implique la synthèse préalable de (NH4)2GdCl5. Ce composé peut être préparé à partir d'oxyde de gadolinium Gd2O3, à une température de 230 °C[2] :
- 10 NH4Cl + Gd2O3 → 2 (NH4)2[GdCl5] + 6 NH3 + 3 H2O
ou bien à partir d'oxyde de gadolinium hexahydraté :
- 4 NH4Cl + 2 GdCl3∙6H2O → 2 (NH4)2[GdCl5] + 12 H2O
ou encore à partir du gadolinium métallique :
- 10 NH4Cl + 2 Gd → 2 (NH4)2[GdCl5] + 6 NH3 + 3 H2
au cours d'une seconde étape, le pentachlorogadolinate d'ammonium se décompose à 300 °C :
- (NH4)2[GdCl5] → GdCl3 + 2 NH4Cl
La réaction de pyrolyse passe par l'intermédiaire NH4[Gd2Cl7].
La première voie évoquée, passant par le chlorure d'ammonium, est la plus répandue et la moins onéreuse. Une variante pour la synthèse de GdCl3 à partir du solide métallique Gd consiste à se placer à une température de 300 °C et à balayer le métal d'un flux de chlorure d'hydrogène HCl[3].
- Gd + 3 HCl → GdCl3 + 3⁄2 H2
Le composé hexahydraté GdCl3∙6H2O est, quant à lui, préparé à partir de l'oxyde de gadolinium et d'acide chlorhydrique concentré[4].
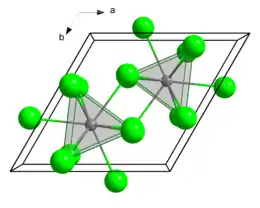
Structure
GdCl3 cristallise dans un réseau hexagonal du type UCl3, de manière analoque à d'autres trichlorures de lanthanides, comme ceux du lanthane, du cérium, du praséodyme, du néodyme, du prométhium, du samarium et de l'europium[5]. Les trichlorures suivants cristallisent dans un motif de type YCl3 : DyCl3, HoCl3, ErCl3, TmCl3, YdCl3, LuCl3. Ainsi, le gadolinium est un élément charnière en termes d'arrangement cristallin dans la famille des lanthanides. Cette position particulière d'élément central de la sixième période est renforcée par la singularité de ses propriétés de spin. Le cristal UCl3 présente neuf sites de coordination, organisés en une sphère de coordination prismatique occupée par trois sites trigonaux. Dans le chlorure de gadolinium(III) hexahydraté GdCl3∙6H2O, ainsi qu'au sein des chlorures et bromures de lanthanides plus petits mentionnés plus haut, c'est cette structure qui régit la disposition des molécules d'eau et des anions Cl− autour des cations métalliques.
Propriétés, applications à l'IRM
Les sels de gadolinium sont des composés d'intérêt pour la composition d'agents de relaxation en imagerie par résonance magnétique (IRM). Cette technique exploite là encore le fait que l'ion Gd3+ soit doté d'une configuration électronique f7. Possédant le nombre maximal de spins parallèles possible, cette espèce entre donc dans la formulation de complexes hautement paramagnétiques[6]. Ces propriétés magnétiques accrues sont la clef d'un contraste et d'une sensibilité élevés, lesquels sont mis à profit dans les techniques de scintigraphie au gadolinium. Afin de générer ce type d'agents de relaxation, GdCl3∙6H2O est converti en complexes de coordination de Gd3+ qui soient biocompatibles. En effet, GdCl3∙6H2O n'est pas utilisable en tant que tel dans une expérience d'IRM du fait de sa trop faible solubilité en milieu aqueux au pH physiologique, lequel est proche de la neutralité[7]. Le gadolinium triplement oxydé sous sa forme libre, i.e. simplement complexé, peut s'avérer toxique. En effet, il peut entrer en compétition avec le calcium dans certains processus métaboliques tels la respiration, les battements cardiaques, ou encore les contractions musculaires. C'est pourquoi, lorsque l'on doit l'utiliser à des fins médicales, il doit toujours être accompagné par des agents chélatants. Des ligands monodentates ou bidentates ne sont pas suffisants dans un contexte biologique car leur constante d'association avec l'ion Gd3+ n'est pas assez élevée en solution. Parmi les agents de chélation polydentates, un candidat naturel est l'EDTA, sous sa forme quatre fois négativement chargée. Ce ligant est hexadentate et est couramment utilisé pour complexer les métaux de transition. Le gadolinium étant un lanthanide, il peut se coordonner plus de six fois, d'où l'usage d'amino-carboxylates plus grands, possédant davantage de sites chélatants.
Un exemple de ce type de composés est le H5DTPA, autrement dit l'acide diéthylènetriaminepenta-acétique[8]. Une fois complexé à la base conjuguée de ce ligand, l'ion chélation Gd3+ voit sa solubilité à pH physiologique grandement augmentée, tout en conservant les propriétés de paramagnétisme nécessaires à son action en tant que produit de contraste pour l'IRM. Le ligand DTPA5− se lie à l'ion Gd3+ avec cinq de ses atomes d'oxygène appartenant à des groupes carboxylate et trois atomes d'azote appartenant aux amines. Le neuvième site de coordination demeure libre et est alors occupé par une molécule d'eau. Cette dernière joue un rôle particulier dans le renforcement du signal émis par le gadolinium. En effet, ce ligand est en échange rapide avec les molécules d'eau environnantes constituant le solvant dans lequel se trouve le complexe. Cet échange permet d'attribuer une signature particulière à un environnement biologique donné. La structure du complexe [Gd(DTPA)(H2O)]2− est un prisme à trois sites trigonaux déformé par la chélation.
Voici un schéma de la réaction de formation du complexe [Gd(DTPA)(H2O)]2− :
.PNG.webp)
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) G. Meyer, « The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3 », Inorganic Syntheses, vol. 25, , p. 146–150 (ISBN 978-0-470-13256-2, DOI 10.1002/9780470132562.ch35)
- John D. Corbett, « Trichlorides of the Rare Earth Elements, Yttrium, and Scandium », Inorganic Syntheses, vol. 22, , p. 39–42 (ISBN 978-0-470-13253-1, DOI 10.1002/9780470132531.ch8)
- L. L. Quill et George L. Clink, « Preparation of Lanthanide Chloride Methanolates Using 2,2-Dimethoxypropane », Inorganic Chemistry, vol. 7, no 7, , p. 1433–1435 (DOI 10.1021/ic50053a032)
- (en) A.F. Wells, Structural Inorganic Chemistry, Oxford, Clarendon Press,
- (en) B. Raduchel, Weinmann, H. et Muhler, A., « Gadolinium Chelates: Chemistry, Safety, & Behavior », Encyclopedia of Nuclear Magnetic Resonance, vol. 4, , p. 2166–2172
- (en) A. J. Spencer, S. A. Wilson, J. Batchelor, A. Reid, J. Pees et E. Harpur, « Gadolinium Chloride Toxicity in the Rat », Toxicologic Pathology, vol. 25, no 3, , p. 245–255 (ISSN 0192-6233, DOI 10.1177/019262339702500301)
- (en) S. Aime, Mauro Botta, Walter Dastru, Mauro Fasano, Maurizio Panero et Aldo Arnelli, « Synthesis and Characterization of a Novel DPTA-like Gadolinium(III) Complex: A Potential Reagent for the Determination of Glycated Proteins by Water Proton NMR Relaxation Measurements », Inorganic Chemistry, vol. 32, no 10, , p. 2068–2071 (DOI 10.1021/ic00062a031)