Oxyde de gadolinium
L'oxyde de gadolinium(III), anciennement appelée gadolinia, est un composé inorganique, l'oxyde du gadolinium métallique Gd, de formule Gd2O3. C'est sous cette forme que l'on trouve le plus couramment le gadolinium dans la nature, celui-ci faisant partie de la famille des terres rares. Dans Gd2O3, Gd possède un degré d'oxydation de trois, assez répandu dans les composés de cet élément. De ce composé, on peut extraire le métal pur, à un degré d'oxydation nul. On peut également synthétiser, à partir d'oxyde de gadolinium, le chlorure de gadolinium(III) (GdCl3). Sous cette forme, le gadolinium peut être utilisé comme agent de contraste pour l'imagerie par résonance magnétique (IRM).
| Oxyde de gadolinium | |

| |
| Identification | |
|---|---|
| Synonymes |
sesquioxyde de gadolinium, trioxyde de gadolinium |
| No CAS | |
| No ECHA | 100.031.861 |
| No RTECS | LW4790000 |
| PubChem | 159427 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche inodore, hygroscopique[1] |
| Propriétés chimiques | |
| Formule | Gd2O3 |
| Masse molaire[2] | 362,5 ± 0,06 g/mol Gd 86,76 %, O 13,24 %, |
| Propriétés physiques | |
| T° fusion | 2 330 °C[1] |
| Solubilité | insoluble dans l'eau[1] |
| Masse volumique | 7,41 g·cm-3 à 15 °C[1] |
| Composés apparentés | |
| Autres anions | l |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
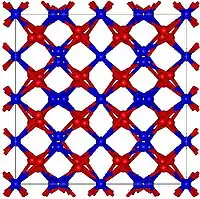
L'oxyde de gadolinium(III) possède principalement deux structures cristallines particulières. La première est cubique simple, semblable à celle de l'oxyde de manganèse(III). Du fait de cet arrangement cristallin cubique, l'oxyde de gadolinium possède deux types de sites de coordination, chacun avec une coordinance de six, mais avec des géométries différentes. La seconde structure découverte pour ce composé est monoclinique[3]. À température ambiante, la forme cubique est la plus stable des deux. Le changement de polymorphe est observable aux alentours de 1 200 °C. Au-delà de 2 100 °C, et ce jusqu'au point de fusion de l'oxyde de gadolinium (2 330 °C), la structure cristalline prédominante est de type hexagonale[3].
Préparation et réactivité
Ce composé peut être obtenu par décomposition thermique d'hydroxydes, de nitrates, de carbonates, ou encore d'oxalates[4]. Une couche d'oxyde se forme également naturellement en surface du gadolinium métallique.
Gd2O3 possède une réactivité relativement basique, comparativement à d'autres oxydes métalliques. Celle-ci étant mise en évidence par sa tendance à se combiner avec le dioxyde de carbone (CO2) pour former des carbonates. L'oxyde de gadolinium se dissout assez bien dans des solvants constitués d'acides minéraux usuels. Toutefois, la très faible solubilité des composés secondaires résultant de sa réactivité, tels les oxalates, les fluorures, les sulfates et les phosphates, limite la dissolution de l'oxyde de gadolinium. En effet, ces composés viennent recouvrir et occulter sa surface, le rendant moins accessible au solvant[5].
Nanoparticules à base de Gd2O3
De nombreuses voies de synthèse conduisent à l'obtention de nanoparticules formées d'oxyde de gadolinium. Les méthodes les plus courantes sont principalement basées sur la précipitation d'hydroxyde de gadolinium après réaction de l'ion métallique avec des ions hydroxyde. Cette réaction est ensuite suivie d'un traitement thermique qui déshydrate l'hydroxyde pour obtenir l'oxyde. Les nanoparticules sont le plus souvent recouvertes d'un matériau protecteur (système cœur-coquille, en anglais : core-shell) afin d'éviter la formation d'agrégats dans le milieu[6] - [7] - [8].
Sous la forme de nanoparticules, l'oxyde de gadolinium est un agent de contraste potentiel pour l'IRM. Un échantillon de particules d'oxyde de gadolinium recouvertes de dextrane, mesurant typiquement de 20 à 40 nm, ont une relaxivité de 4,8 s-1·mM-1 par ion sous un champ de 7,05 T, ce qui en fait un matériau de choix pour une telle application. Il faut noter toutefois que cette donnée a été obtenue en laboratoire, en travaillant avec des champs magnétiques beaucoup plus élevées que ceux des scanners couramment utilisés dans le milieu médical, où les intensités sont plutôt de l'ordre de 0,5 à 3 T[6].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Gadolinium(III) oxide » (voir la liste des auteurs).
- (en) S. Dierks, « Gadolinium Oxide », ESPI Metals, (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Wells A.F. (1984), Structural Inorganic Chemistry, 5e éd., Oxford Science Publications (ISBN 0-19-855370-6).
- (en) Cotton, S. (2006), Lanthanide and Actinide Chemistry, Wiley, p. 6 (ISBN 0-470-01006-1)
- (en) Yost, D.M., Russell, H. Jr., Garner, C.S., The Rare-Earth Elements and their Compounds, Wiley, 1947.
- (en) M McDonald et K Watkin, « Investigations into the Physicochemical Properties of Dextran Small Particulate Gadolinium Oxide Nanoparticles », Academic Radiology, vol. 13, no 4, , p. 421–7 (PMID 16554221, DOI 10.1016/j.acra.2005.11.005)
- (en) Jean-Luc Bridot, Anne-Charlotte Faure, Sophie Laurent, Charlotte Rivière, Claire Billotey, Bassem Hiba, Marc Janier, VéRonique Josserand, Jean-Luc Coll, Luce Vander Elst, Robert Muller, Stéphane Roux, Pascal Perriat et Olivier Tillement, « Hybrid Gadolinium Oxide Nanoparticles: Multimodal Contrast Agents for in Vivo Imaging », Journal of the American Chemical Society, vol. 129, no 16, , p. 5076–84 (PMID 17397154, DOI 10.1021/ja068356j)
- (en) Maria Engström, Anna Klasson, Henrik Pedersen, Cecilia Vahlberg, Per-Olov Käll et Kajsa Uvdal, « High proton relaxivity for gadolinium oxide nanoparticles », Magnetic Resonance Materials in Physics, Biology and Medicine, vol. 19, no 4, , p. 180–6 (PMID 16909260, DOI 10.1007/s10334-006-0039-x)
- (en) « Gadolinium », sur Magnetic Resonance TIP-MRI Database (consulté le )
- (en) « Gadolinium », sur Webelements (consulté le )