Chlorure d'ammonium
Le chlorure d'ammonium est un solide ionique de formule chimique NH4Cl.
| Chlorure d'ammonium | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| DCI | ammonium chlorure | |
| Nom UICPA | Chlorure d'ammonium | |
| No CAS | ||
| No ECHA | 100.031.976 | |
| No CE | 235-186-4 | |
| Code ATC | B05 G04 | |
| No E | E510 | |
| Apparence | solide blanc | |
| Propriétés chimiques | ||
| Formule | NH4Cl | |
| Masse molaire[1] | 53,491 ± 0,002 g/mol H 7,54 %, Cl 66,28 %, N 26,19 %, |
|
| pKa | 9,245 | |
| Propriétés physiques | ||
| T° fusion | 338 °C sublime | |
| T° ébullition | 520 °C | |
| Solubilité | sol. dans la glycérine,
peu sol. dans le méthanol et l'éthanol, presqu'insol. dans l'acétone, l'éther, l'acétate d'éthyle[2]; 29,7 g/100g (0 °C, eau) |
|
| Masse volumique | 1,527 g·cm-3 [2] | |
| Pression de vapeur saturante | 133,3 Pa à 160 °C [2] | |
| Point critique | 16,4 bar à 608,85 °C [3] | |
| Thermochimie | ||
| S0solide | 94,85 J/mol·K | |
| ΔfH0solide | -314,55 kJ/mol | |
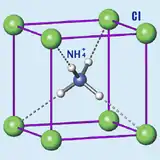
| Cristallographie | ||
| Structure type | NaCl[4] | |
| Précautions | ||
| Directive 67/548/EEC[5] | ||
 Xn |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
Description
Le chlorure d'ammonium pur est un sel cristallin blanc. Il est très soluble dans l'eau, avec une solubilité dans l'eau de 372 g par kg d'eau à 20 °C. La solution aqueuse est légèrement acide.
À température ambiante, le chlorure d'ammonium cristallise dans un système cubique, de groupe d'espace P m -3 m (structure type CsCl). À 456 K, il présente une transition structurale vers le groupe d'espace F m -3 m (structure type NaCl)[6].
Sa masse molaire est 53,49 g mol−1 et sa densité de 1,527 4 g/cm3. Il se décompose à 338 °C.
Ce composé est dangereux pour la santé :
- R22 : nocif par ingestion ;
- R36 : irritant pour les yeux ;
- S22 : ne pas inhaler les poussières.
À faible doses, il entre dans la composition de produits alimentaires ; le codex alimentarius lui attribue le numéro E 510[7].
Il existe naturellement et est connu depuis l'antiquité, sous le nom de salmiac. Il est produit industriellement de nos jours principalement par réaction du chlorure d'hydrogène sur l'ammoniac, suivant la réaction : HCl + NH3 → NH4Cl.
Origine
Dans la nature, cette substance minérale nommée salmiac, par abréviation du latin médiéval "sal ammoniac", par les minéralogistes apparaît dans les régions volcaniques, se déposant sur les rochers près de cheminées de volcans. Les cristaux se précipitent directement de la phase gazeuse (sublimés) et y restent peu de temps puisqu'ils sont facilement solubles dans l'eau.
On le trouve aussi dans des mines profondes. En Égypte, vieux pays principal exportateur autrefois de ce sel nommé sal ammoniac, il était extrait par sublimation de la suie, provenant de la combustion de la fiente de chameaux. Le chimiste Berzelius, auteur de cette remarque dans son traité de chimie, précise qu'il provient essentiellement depuis le XVIIIe siècle en Europe de la distillation d'os en cornue. Il est extrait du mélange brun des carbonates grâce à l'acide sulfurique. Le chlorure d'ammonium était obtenu conjointement avec le sulfate de sodium et facilement séparé.
Le chlorure d'ammonium est préparé industriellement par réaction de l'ammoniac (NH3) avec le chlorure d'hydrogène (HCl) :
- NH3 + HCl → NH4Cl
Une expérience classique consiste à tremper une baguette de verre dans une solution ammoniacale et d'approcher cette baguette humectée du goulot d'une bouteille d'acide chlorhydrique en solution aqueuse : les vapeurs d'ammoniac et d'acide chlorhydrique réagissent en produisant des filets blancs ténus de chlorure d'ammonium.
Usages
On utilise le chlorure d'ammonium ou souvent le salmiac :
- en métallurgie et chimie des métaux :
- le brasage tendre : comme composant de certains flux et sous forme solide, sous le nom commercial de pierre ammoniacale, pour décaper la panne des fers à braser ;
- divers soudages ;
- le nettoyage des métaux ferreux et non-ferreux, comme le cuivre et le zinc ;
- étamage des récipients de fer ou de cuivre, en dinanderie ;
- les piles Leclanché : électrolyte de la pile sèche ;
- l'étude de la solidification : le chlorure d'ammonium dans l'eau solidifie comme un alliage métallique dendritique ;
- pour ses propriétés de surface, en particulier comme produit de nettoyage des métaux ou son action sur d'autres surfaces spécifiques :
- le traitement de la neige, spécialement sur les pistes à des températures au-dessus de 0 °C pour solidifier la neige et retarder sa fusion ;
- en photographie scientifique, en particulier dans la photographie de roches ou de fossiles, dans le but de blanchir les surfaces. Pulvérisé sur une surface brillante, cela permet de la rendre mate, tout en soulignant le moindre détail de façon très discrète ;
- produit de nettoyages divers ;
- en cosmétique, dans les shampooings ;
- pour la teinture des textiles ;
- dans les colles pour contreplaqués ;
- dans l'industrie ou les préparations agro-alimentaires :
- en médecine humaine ou vétérinaire :
- les médicaments contre la toux ; son action expectorante est due au fait qu'il irrite les muqueuses des bronches ;
- en immunohistochimie pour la séparation des anticorps polyclonaux et des autres protéines sériques de la saignée, par précipitation ;
- dans un test pour diagnostiquer l'acidose tubulaire rénale ;
- suppléments alimentaires pour le bétail (sur ordonnance vétérinaire).
Source
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ammonium chloride » (voir la liste des auteurs).
Référence
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Raymond C Rowe, Paul J Sheskey, Marian E Quinn, Handbook of Pharmaceutical Excipients, Londres, Pharmaceutical Press and American Pharmacists Association, , 6e éd., 888 p. (ISBN 978-0-85369-792-3), p. 42
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Structure and Chemistry of Crystalline Solids [« Bodie E. Douglas »], Pittsburgh, PA, USA, Springer Science + Business Media, Inc., , 346 p. (ISBN 978-0-387-36687-6 et 978-0-387-26147-8, OCLC 262687454, lire en ligne), p. 64
- « chlorure d'ammonium », sur ESIS, consulté le 3 mars 2010
- K. Mansikka & J. Poyhonen, Annales Academiae Scientiarum Fennicae, Series A6: Physica, 1962, 118
- (en) Noms de catégorie et système international de numérotation des additifs alimentaires - Codex Alimentarius
Bibliographie
- Jöns Jakob Berzelius, Traité de chimie minérale, végétale et animale, Volume 4, F. Didot, 1831. Traduction de l'allemand en français par Antoine-Jacques-Louis Jourdan et Melchior Esslinger. En particulier, sur les sels d'ammonium, page 1 à 4.