Anticorps à domaine unique
Un anticorps à domaine unique (sdAb, de l'anglais : single-domain antibody), également connu sous le nom de nanocorps, est un fragment d'anticorps composé d'un seul domaine d'anticorps variable monomère. Comme un anticorps entier, il est capable de se lier sélectivement à un antigène spécifique. Avec un poids moléculaire de seulement 12 à 15 kDa, les anticorps à domaine unique sont beaucoup plus petits que les anticorps communs (150 à 160 kDa) qui sont composés de deux chaînes de protéines lourdes et de deux chaînes légères, et même plus petits que les fragments Fab (~ 50 kDa, une chaîne légère et une demi-chaîne lourde) et des fragments variables à chaîne unique (~ 25 kDa, deux domaines variables, l'un issu d'une chaîne légère et l'autre d'une chaîne lourde)[1].
Les premiers anticorps à domaine unique ont été conçus à partir d' anticorps à chaîne lourde trouvés chez les camélidés ; ils sont appelés fragments VHH. Les poissons cartilagineux possèdent également des anticorps à chaîne lourde (IgNAR, de l'anglais immunoglobuline new antigen receptor, « récepteur des nouveaux antigènes d'immunoglobuline »), à partir desquels des anticorps à domaine unique appelés fragments VNAR peuvent être obtenus[2]. Une approche alternative consiste à diviser les domaines variables dimériques de l'immunoglobuline G (IgG) commune des humains ou des souris en monomères. Bien que la plupart des recherches sur les anticorps à domaine unique soient actuellement basées sur des domaines variables de chaîne lourde, il a également été démontré que les nanocorps dérivés de chaînes légères se lient spécifiquement aux épitopes cibles[3].
Il a été démontré que les anticorps de camélidés à domaine unique sont tout aussi spécifiques qu'un anticorps ordinaire et, dans certains cas, sont plus robustes. De plus, ils sont facilement isolés en utilisant la même procédure de panoramique de phage que celle utilisée pour les anticorps traditionnels, ce qui leur permet d'être cultivés in vitro en grandes concentrations. La taille plus petite et le domaine unique facilitent la transformation de ces anticorps en cellules bactériennes pour la production en masse, ce qui les rend idéaux à des fins de recherche[4].
Des anticorps à domaine unique font l'objet de recherches pour de multiples applications pharmaceutiques et pourraient être utilisés dans le traitement du syndrome coronarien aigu, du cancer et de la maladie d'Alzheimer[5] - [6].
Propriétés
Un anticorps à domaine unique est une chaîne peptidique longue d'environ 110 acides aminés, comprenant un domaine variable (VH) d'un anticorps à chaîne lourde ou d'une IgG commune. Ces peptides ont une affinité aux antigènes similaire à celle des anticorps entiers, mais sont plus résistants à la chaleur et stables vis-à-vis des détergents et des concentrations élevées d'urée. Ceux dérivés des anticorps de camélidés et de poissons sont moins lipophiles et plus solubles dans l'eau, en raison de leur région 3 déterminant la complémentarité (CDR3, complementarity-determining region 3), qui forme une boucle étendue (de couleur orange dans la représentation du ruban ci-dessus) couvrant le site lipophile qui se lie normalement à une chaîne légère[7] - [8]. Contrairement aux anticorps courants, deux sur six anticorps à domaine unique ont résisté à une température de 90 °C (194°F) sans perdre leur capacité à se lier aux antigènes, selon une étude de 1999[9]. La stabilité vis-à-vis de l'acide gastrique et des protéases dépend de la séquence d'acides aminés. Certaines espèces se sont révélées actives dans l'intestin après administration par voie orale[10] - [11] mais leur faible absorption par l'intestin entrave le développement d'anticorps à domaine unique administrés par voie orale pour des indications systémiques.
La masse moléculaire relativement faible conduit à une meilleure perméabilité dans les tissus et à une courte demi-vie plasmatique puisqu'elles sont éliminées par voie rénale[12]. Contrairement aux anticorps entiers, ils ne présentent pas de cytotoxicité déclenchée par le système du complément car ils n'ont pas de région Fc . Les sdAbs dérivés des camélidés et des poissons sont capables de se lier à des antigènes masqués qui ne sont pas accessibles à des anticorps entiers, par exemple aux sites actifs des enzymes[13]. Il a été démontré que cette propriété résulte de leur boucle CDR3 étendue, qui est capable d'accéder à de tels sites[14] - [15].
Production
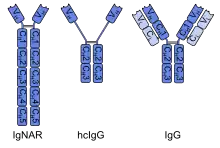
À partir d'anticorps à chaîne lourde
Un anticorps à domaine unique peut être obtenu par immunisation de dromadaires, chameaux, lamas, alpagas ou requins avec l'antigène souhaité et isolement ultérieur de l'ARNm codant les anticorps à chaîne lourde. En utilisant une méthode de construction de bibliothèque basée sur PCR-Extension Assembly and Self-Ligation (nommée « EASeL »), Mitchell Ho et Martin Flajnik ont établi une grande bibliothèque d'anticorps VNAR d'une taille de 1,2 × 1010 à partir de requins nourrices naïfs. Les techniques de criblage telles que l'affichage des phages et l'affichage des ribosomes aident à identifier les clones se liant à l'antigène[16] - [17].
À partir d'anticorps conventionnels
Alternativement, des anticorps à domaine unique peuvent être fabriqués à partir d'IgG murine commune[18] lapin[19] ou humaine à quatre chaînes[20]. Le processus est similaire, comprenant des bibliothèques de gènes de donneurs immunisés ou naïfs et des techniques d'affichage pour l'identification des antigènes les plus spécifiques. Un problème avec cette approche est que la région de liaison des IgG communes se compose de deux domaines (VH et VL), qui ont tendance à se dimériser ou à s'agréger en raison de leur lipophilicité. La monomérisation est généralement réalisée en remplaçant les acides aminés lipophiles par des acides aminés hydrophiles, mais entraîne souvent une perte d'affinité pour l'antigène[21]. Si l'affinité peut être conservée, les anticorps à domaine unique peuvent également être produits dans E. coli, S. cerevisiae ou d'autres organismes.
À partir d'anticorps humains à domaine unique
Mitchell Ho et Dimiter Dimitrov du National Cancer Institute ont isolé des anticorps humains à domaine unique ciblant divers antigènes tumoraux, dont la mésothéline[22], GPC2[23] et GPC3[24] - [25] à partir d'une bibliothèque d'affichage de phages de domaine VH humain conçue[26]. Les anticorps humains à domaine unique ont été utilisés pour créer des immunotoxines (HN3-PE38, HN3-mPE24, HN3-T20)[27] - [28] et des cellules T réceptrices d'antigène chimérique (CAR, chimeric antigen receptor)[29] pour un traitement anticancéreux. Le blocage du domaine de liaison Wnt sur GPC3 par l'anticorps humain à domaine unique HN3 inhibe l'activation Wnt dans les cellules cancéreuses du foie[30].
Applications potentielles
Les anticorps à domaine unique trouvent une large gamme d'applications dans les domaines biotechniques et thérapeutiques en raison de leur petite taille, de leur production simple et de leur affinité élevée[31] - [32].
Biotechnologie et diagnostic
La fusion d'une protéine fluorescente à un nanocorps génère ce qu'il est convenu d'appeler un chromocorps. Des chromocorps peuvent être utilisés pour reconnaître et tracer des cibles dans différents organites de cellules vivantes. Ils peuvent donc augmenter les possibilités de la microscopie de cellules vivantes et permettront de nouvelles études fonctionnelles[33]. Le couplage d'un nanocorps anti-GFP à une matrice monovalente, appelée GFP-nanotrap, permet l'isolement des protéines de fusion GFP et de leurs partenaires d'interaction, pour de nouvelles analyses biochimiques[34]. La localisation d'une seule molécule avec des techniques d'imagerie de super-résolution nécessite l'acheminement spécifique de fluorophores à proximité immédiate d'une protéine cible. En raison de leur grande taille, l'utilisation d'anticorps couplés à des colorants organiques peut souvent conduire à un signal trompeur en raison de la distance entre le fluorophore et la protéine cible. La fusion de colorants organiques avec des nanocorps anti-GFP ciblant les protéines marquées GFP permet une résolution spatiale nanométrique et une erreur de liaison minimale en raison de la petite taille et de la haute affinité[35]. La fraction de taille des nanocorps profite également à l'étude de microscopie électronique à lumière corrélative. Sans aucun agent de perméabilisation, le cytoplasme des cellules fixées chimiquement est facilement accessible aux nanocorps marqués au fluorophore. Leur petite taille leur permet également de pénétrer plus profondément dans les échantillons volumétriques que les anticorps ordinaires. Une haute qualité structurale est préservée dans les tissus qui sont explorés par microscope à fluorescence puis microscope électronique. Ceci est particulièrement utile pour la recherche en neurosciences qui nécessite à la fois un marquage moléculaire et une imagerie microscopique électronique[36].
Dans les applications de biocapteurs diagnostiques, les nanocorps peuvent être utilisés de manière prospective comme outil. En raison de leur petite taille, ils peuvent être couplés de manière plus dense sur les surfaces des biocapteurs. En plus de leur avantage à cibler des épitopes moins accessibles, leur stabilité conformationnelle conduit également à une résistance plus élevée aux conditions de régénération de surface. Après avoir immobilisé des anticorps à domaine unique sur les surfaces des capteurs, la détection de l'antigène spécifique de la prostate humaine (hPSA) a été testée. Les nanocorps ont surpassé les anticorps classiques dans la détection de concentrations cliniques significatives de hPSA[37].
Pour augmenter la probabilité de cristallisation d'une molécule cible, les nanocorps peuvent être utilisés comme chaperons de cristallisation. En tant que protéines auxiliaires, elles peuvent réduire l'hétérogénéité conformationnelle en se liant et en stabilisant juste un sous-ensemble d'états conformationnels. Ils peuvent également masquer les surfaces qui interfèrent avec la cristallisation tout en étendant les régions qui forment des contacts cristallins [38] - [32].
Thérapeutique
Les anticorps à domaine unique ont été testés comme un nouvel outil thérapeutique contre plusieurs cibles. Chez les souris infectées par le sous-type du virus de la grippe A H5N1, les nanocorps dirigés contre l'hémagglutinine ont supprimé la réplication du virus H5N1 in vivo et ont réduit la morbidité et la mortalité[39]. Il a été démontré que des nanocorps ciblant le domaine de liaison au récepteur cellulaire des facteurs de virulence, la toxine A et la toxine B de Clostridium difficile, neutralisent les effets pathologiques pour les cellules, sur des fibroblastes, in vitro[40]. Des conjugués nanocorps reconnaissant des cellules présentant un antigène ont été utilisés avec succès pour la détection de tumeurs[41] ou la distribution ciblée d'antigènes pour générer une forte réponse immunitaire[42].
Des anticorps à domaine unique administrés par voie orale contre la diarrhée provoquée par E. coli chez les porcelets ont été développés et testés avec succès[43]. D'autres maladies du tractus gastro-intestinal, telles que la maladie inflammatoire de l'intestin et le cancer du côlon, sont également des cibles possibles pour les anticorps à domaine unique administrés par voie orale[44].
Des espèces stables aux détergents ciblant une protéine de surface de Malassezia furfur ont été conçues pour être utilisées dans les shampooings antipelliculaires[45].
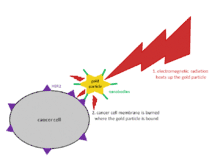
En tant qu'approche pour la thérapie photothermique, les nanocorps se liant à l'antigène HER2, qui est surexprimé dans les cellules cancéreuses du sein et de l'ovaire, ont été conjugués à des nanoparticules d'or ramifiées (voir figure). Les cellules tumorales ont été détruites par photothermie à l'aide d'un laser dans un environnement de test[46].
Le caplacizumab, un anticorps à domaine unique ciblant le facteur von Willebrand, fait l'objet d'essais cliniques pour la prévention de la thrombose chez les patients atteints du syndrome coronarien aigu[47]. Une étude de phase II examinant ALX-0081 dans une intervention coronarienne percutanée à haut risque a débuté en septembre 2009.
Ablynx prévoit que ses nanocorps pourraient traverser la barrière hémato-encéphalique et pénétrer dans de grandes tumeurs solides plus facilement que des anticorps entiers, ce qui permettrait le développement de médicaments contre les cancers du cerveau[48].
Dans la lutte contre le coronavirus SARS-Cov-2, qui cause la maladie covid-19, les nanocorps sont pris en considération comme un possible remède. Un anticorps de taille normale ne peut s'accrocher qu'aux pointes des épines des protéines qui recouvrent ce coronavirus. Grâce à leur taille, les nancorps pourront plonger dans les poches et les crevasses entre les épines en franchissant les possibles défenses que le virus peut avoir mis en place. Cette approche ainsi que d'autres comprenant des anticorps sont évaluées pour contrer la covid-19[49].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Single-domain antibody » (voir la liste des auteurs).
- « Properties, production, and applications of camelid single-domain antibody fragments », Applied Microbiology and Biotechnology, vol. 77, no 1, , p. 13–22 (PMID 17704915, PMCID 2039825, DOI 10.1007/s00253-007-1142-2)
- (en) English, Hong et Ho, « Ancient species offers contemporary therapeutics: an update on shark VNAR single domain antibody sequences, phage libraries and potential clinical applications », Antibody Therapeutics, vol. 3, no 1, , p. 1–9 (PMID 32118195, PMCID 7034638, DOI 10.1093/abt/tbaa001)
- « Intracellular activation of interferon regulatory factor-1 by nanobodies to the multifunctional (Mf1) domain », The Journal of Biological Chemistry, vol. 285, no 49, , p. 38348–61 (PMID 20817723, PMCID 2992268, DOI 10.1074/jbc.M110.149476)
- « Camelid nanobodies with high affinity for broad bean mottle virus: a possible promising tool to immunomodulate plant resistance against viruses », Plant Molecular Biology, vol. 87, nos 4–5, , p. 355–69 (PMID 25648551, DOI 10.1007/s11103-015-0282-5)
- (en) « Nanobodies herald a new era in cancer therapy »,
- (en) « Pipeline », Ablynx (consulté le )
- (en) « Isolation of llama antibody fragments for prevention of dandruff by phage display in shampoo », Applied and Environmental Microbiology, vol. 71, no 1, , p. 442–50 (PMID 15640220, PMCID 544197, DOI 10.1128/AEM.71.1.442-450.2005)
- (en) « Crystal structure of a shark single-domain antibody V region in complex with lysozyme », Science, vol. 305, no 5691, , p. 1770–3 (PMID 15319492, DOI 10.1126/science.1101148, Bibcode 2004Sci...305.1770S)
- « Comparison of physical chemical properties of llama VHH antibody fragments and mouse monoclonal antibodies », Biochimica et Biophysica Acta, vol. 1431, no 1, , p. 37–46 (PMID 10209277, DOI 10.1016/S0167-4838(99)00030-8)
- « Escherichia coli F4 fimbriae specific llama single-domain antibody fragments effectively inhibit bacterial adhesion in vitro but poorly protect against diarrhoea », Veterinary Microbiology, vol. 111, nos 1–2, , p. 89–98 (PMID 16221532, DOI 10.1016/j.vetmic.2005.09.005)
- « Selection and optimization of proteolytically stable llama single-domain antibody fragments for oral immunotherapy », Applied Microbiology and Biotechnology, vol. 72, no 3, , p. 544–51 (PMID 16450109, DOI 10.1007/s00253-005-0300-7, lire en ligne)
- « Properties, production, and applications of camelid single-domain antibody fragments », Applied Microbiology and Biotechnology, vol. 77, no 1, , p. 13–22 (PMID 17704915, PMCID 2039825, DOI 10.1007/s00253-007-1142-2)
- « Inaugural Editorial: Searching for Magic Bullets », Antibody Therapeutics, vol. 1, no 1, , p. 1–5 (PMID 30101214, PMCID 6086361, DOI 10.1093/abt/tby001)
- « Crystal structure of a shark single-domain antibody V region in complex with lysozyme », Science, vol. 305, no 5691, , p. 1770–3 (PMID 15319492, DOI 10.1126/science.1101148, Bibcode 2004Sci...305.1770S)
- « Crystal structure of a camel single-domain VH antibody fragment in complex with lysozyme », Nature Structural Biology, vol. 3, no 9, , p. 803–11 (PMID 8784355, DOI 10.1038/nsb0996-803)
- (en) « Selection and identification of single domain antibody fragments from camel heavy-chain antibodies », FEBS Letters, vol. 414, no 3, , p. 521–6 (PMID 9323027, DOI 10.1016/S0014-5793(97)01062-4)
- (en) « NAR single-domain antibody library from six naïve nurse sharks », Antibody Therapeutics, vol. 2, no 1, , p. 1–11 (PMID 30627698, PMCID 6312525, DOI 10.1093/abt/tby011)
- (en) Ward, Güssow, Griffiths et Jones, « Binding activities of a repertoire of single immunoglobulin variable domains secreted from Escherichia coli », Nature, vol. 341, no 6242, , p. 544–546 (ISSN 0028-0836, PMID 2677748, DOI 10.1038/341544a0, Bibcode 1989Natur.341..544W)
- (en) Feng, Wang, Hong et Dower, « Isolation of rabbit single domain antibodies to B7-H3 via protein immunization and phage display », Antibody Therapeutics, vol. 3, no 1, , p. 10–17 (ISSN 2516-4236, PMID 32166218, PMCID 7052794, DOI 10.1093/abt/tbaa002)
- (en) « Domain antibodies: proteins for therapy », Trends in Biotechnology, vol. 21, no 11, , p. 484–90 (PMID 14573361, DOI 10.1016/j.tibtech.2003.08.007)
- (en) « Antibody evolution beyond Nature », Nature Biotechnology, vol. 20, no 12, , p. 1189–90 (PMID 12454662, DOI 10.1038/nbt1202-1189)
- (en) « A human single-domain antibody elicits potent antitumor activity by targeting an epitope in mesothelin close to the cancer cell surface », Molecular Cancer Therapeutics, vol. 12, no 4, , p. 416–26 (PMID 23371858, PMCID 3624043, DOI 10.1158/1535-7163.MCT-12-0731)
- (en) « Therapeutically targeting glypican-2 via single-domain antibody-based chimeric antigen receptors and immunotoxins in neuroblastoma », Proceedings of the National Academy of Sciences of the United States of America, vol. 114, no 32, , E6623–E6631 (PMID 28739923, PMCID 5559039, DOI 10.1073/pnas.1706055114)
- (en) « Therapeutically targeting glypican-3 via a conformation-specific single-domain antibody in hepatocellular carcinoma », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 12, , E1083-91 (PMID 23471984, PMCID 3607002, DOI 10.1073/pnas.1217868110, Bibcode 2013PNAS..110E1083F)
- (en) « Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis », Nature Communications, vol. 6, , p. 6536 (PMID 25758784, PMCID 4357278, DOI 10.1038/ncomms7536, Bibcode 2015NatCo...6.6536G)
- (en) « Construction of a large phage-displayed human antibody domain library with a scaffold based on a newly identified highly soluble, stable heavy chain variable domain », Journal of Molecular Biology, vol. 382, no 3, , p. 779–89 (PMID 18687338, PMCID 2551765, DOI 10.1016/j.jmb.2008.07.054)
- (en) « Construction of an immunotoxin, HN3-mPE24, targeting glypican-3 for liver cancer therapy », Oncotarget, vol. 8, no 20, , p. 32450–32460 (PMID 27419635, PMCID 5464801, DOI 10.18632/oncotarget.10592)
- (en) « The engineered anti-GPC3 immunotoxin, HN3-ABD-T20, produces regression in mouse liver cancer xenografts via prolonged serum retention », Hepatology, vol. 71, no 5, , p. 1696–1711 (PMID 31520528, PMCID 7069773, DOI 10.1002/hep.30949)
- Trinh, Wu, Chang et Ho, « Abstract 2316: GPC3-specific chimeric antigen receptor T cell in combination with Sorafenib as a novel therapeutic treatment for hepatocellular carcinoma », Immunology, American Association for Cancer Research, , p. 2316 (DOI 10.1158/1538-7445.AM2016-2316)
- (en) « A Frizzled-Like Cysteine-Rich Domain in Glypican-3 Mediates Wnt Binding and Regulates Hepatocellular Carcinoma Tumor Growth in Mice », Hepatology, vol. 70, no 4, , p. 1231–1245 (PMID 30963603, PMCID 6783318, DOI 10.1002/hep.30646)
- (en) « Nanobodies: natural single-domain antibodies », Annual Review of Biochemistry, vol. 82, , p. 775–97. (PMID 23495938, DOI 10.1146/annurev-biochem-063011-092449)
- (en) « Targeting G protein-coupled receptor signaling at the G protein level with a selective nanobody inhibitor », Nature Communications, vol. 9, no 1, , p. 1996 (PMID 29777099, PMCID 5959942, DOI 10.1038/s41467-018-04432-0, Bibcode 2018NatCo...9.1996G)
- (en) « Targeting and tracing antigens in live cells with fluorescent nanobodies », Nature Methods, vol. 3, no 11, , p. 887–9 (PMID 17060912, DOI 10.1038/nmeth953)
- (en) « A versatile nanotrap for biochemical and functional studies with fluorescent fusion proteins », Molecular & Cellular Proteomics, vol. 7, no 2, , p. 282–9 (PMID 17951627, DOI 10.1074/mcp.M700342-MCP200)
- (en) « A simple, versatile method for GFP-based super-resolution microscopy via nanobodies », Nature Methods, vol. 9, no 6, , p. 582–4 (PMID 22543348, DOI 10.1038/nmeth.1991)
- « Nanobody immunostaining for correlated light and electron microscopy with preservation of ultrastructure », Nature Methods, vol. 15, no 12, , p. 1029–1032 (PMID 30397326, PMCID 6405223, DOI 10.1038/s41592-018-0177-x)
- (en) « Engineering camel single-domain antibodies and immobilization chemistry for human prostate-specific antigen sensing », Analytical Chemistry, vol. 77, no 23, , p. 7547–55 (PMID 16316161, DOI 10.1021/ac051092j)
- (en) « Engineering of recombinant crystallization chaperones », Current Opinion in Structural Biology, vol. 19, no 4, , p. 449–57 (PMID 19477632, PMCID 2736338, DOI 10.1016/j.sbi.2009.04.008)
- (en) « Nanobodies with in vitro neutralizing activity protect mice against H5N1 influenza virus infection », The Journal of Infectious Diseases, vol. 203, no 8, , p. 1063–72 (PMID 21450996, DOI 10.1093/infdis/jiq168)
- (en) « Neutralization of Clostridium difficile toxin A with single-domain antibodies targeting the cell receptor binding domain », The Journal of Biological Chemistry, vol. 286, no 11, , p. 8961–76. (PMID 21216961, PMCID 3058971, DOI 10.1074/jbc.M110.198754)
- « Structurally Defined αMHC-II Nanobody-Drug Conjugates: A Therapeutic and Imaging System for B-Cell Lymphoma », Angewandte Chemie, vol. 55, no 7, , p. 2416–20 (PMID 26840214, PMCID 4820396, DOI 10.1002/anie.201509432)
- (en) « Targeted antigen delivery by an anti-class II MHC VHH elicits focused αMUC1(Tn) immunity », Chemical Science, vol. 8, no 8, , p. 5591–5597 (PMID 28970938, PMCID 5618788, DOI 10.1039/c7sc00446j)
- (en) « Selection and optimization of proteolytically stable llama single-domain antibody fragments for oral immunotherapy », Applied Microbiology and Biotechnology, vol. 72, no 3, , p. 544–51 (PMID 16450109, DOI 10.1007/s00253-005-0300-7, lire en ligne)
- (en) « Nanobodies », Nanobody.org,
- « Isolation of llama antibody fragments for prevention of dandruff by phage display in shampoo », Applied and Environmental Microbiology, vol. 71, no 1, , p. 442–50 (PMID 15640220, PMCID 544197, DOI 10.1128/AEM.71.1.442-450.2005)
- « Specific cell targeting with nanobody conjugated branched gold nanoparticles for photothermal therapy », ACS Nano, vol. 5, no 6, , p. 4319–28 (PMID 21609027, DOI 10.1021/nn1023363)
- (en) « Ablynx Announces Interim Results of First Nanobody Phase I Study of,ALX-0081 (ANTI-VWF) », Bio-Medicine.org,
- « Nanobodies », sur www.nanobody.org,
- (en) Liam Mannix, « Alpacas provide new hope for a COVID-19 cure », sur www.theage.com.au The Age, (consulté le )
.png.webp)