Anisakiase
L'anisakiase ou anisakidose est une parasitose cosmopolite, observée surtout au Japon (après consommation de sushi et de sashimi), en Scandinavie (foies de cabillaud), aux Pays-Bas (harengs conservés ou Maatjes) et le long de la côte Pacifique de l'Amérique du Sud (ceviches).

| Causes | Anisakis |
|---|---|
| Transmission | Contamination féco-orale |
| Symptômes | Nausée, vomissement, douleur abdominale, diarrhée, fièvre, éosinophilie et allergie |
| Médicament | Albendazole, mébendazole, flubendazole et ivermectine |
|---|---|
| Spécialité | Infectiologie |
![]() Mise en garde médicale
Mise en garde médicale
Anisakis est un genre de nématodes parasites, qui au cours de leur vie passent par des poissons et des mammifères marins. Ils peuvent infecter les êtres humains et provoquent l'anisakiase. La consommation de poisson cru infecté par Anisakis spp. peut provoquer une réaction avec un choc anaphylactique chez les personnes sensibilisées dont l’organisme produit des immunoglobulines E (IgE) spécifiques.
Parasites en cause
Anisakis spp., familièrement appelé ver du hareng, ver de morue, ver de baleine ; Pseudoterranova spp., ver de phoque.
Ce sont des nématodes de l’ordre des Ascaridida, de la famille des anisakidés.
Le genre Anisakis comprend plusieurs espèces : A. pegreffii, A. physeteris, A. schupakovi, A. simplex, A. typica, A. ziphidarum.
Pseudoterranova decipiens est un complexe d'espèces.
Les anisakidés constituent un risque pour la santé humaine de deux façons :
- par infestation après ingestion de poissons mal préparés ;
- par réaction allergique aux produits chimiques exécrés par les vers dans la chair du poisson.
Liste des espèces d’Anisakis
N.B. : cette liste ne présente que les espèces européennes.
- Anisakis pegreffii Campana-Rouget & Biocca, 1955
- Anisakis physeteris Baylis, 1923
- Anisakis simplex (Rudolphi, 1809) Dujardin, 1845 - Ver du hareng
Infestation
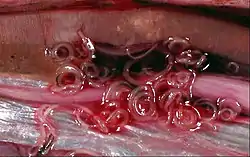
L’anisakiase est la maladie due à l'infestation par des vers Anisakis. On la rencontre fréquemment dans les aires géographiques où le poisson est consommé cru, peu cuit ou conservé dans des préparations à faible teneur en saumure ou acide acétique. Parmi les différentes préparations culinaires pouvant être à l’origine de contaminations, citons les sushis (poisson cru), la boutargue (préparation à base d’œufs de poisson), les rollmops (harengs marinés dans du vin blanc ou du vinaigre), le hareng saur (poisson fumé), le poisson à la tahitienne ou le « ceviche » (poisson cuit dans du citron). Les aires de plus grande fréquence sont la Scandinavie (consommation de foie de morue), le Japon (consommation de sushi et de sashimi), les Pays-Bas (consommation de harengs fermentés infectés Maatjes) et le long de la côte Pacifique de l'Amérique du Sud (consommation de ceviche). La cuisson à 60 °C, ou la congélation au-dessous de −20 °C durant 24 h sont des méthodes efficaces pour tuer les Anisakidés[1].
Chez l'humain, les larves vivantes d'anisakidés meurent en quelques jours après l’ingestion et n’évoluent jamais en adultes (impasse parasitaire).
Dans les heures qui suivent l'ingestion de larves contagieuses peuvent survenir des nausées, des vomissements et des douleurs abdominales violentes. Occasionnellement des larves peuvent être expulsées dans les crachats.
Cependant, après un repas contaminant (l’ingestion d’une seule larve suffit à provoquer la maladie), les larves peuvent se fixer sur la paroi du tube digestif et tenter de s'y enfoncer, déterminant plusieurs syndromes, dont les principaux sont :
- manifestations pseudo-ulcéreuses, en cas de fixation à la paroi gastrique ou duodénale ; elles surviennent quelques heures après l'ingestion, et peuvent s'accompagner de troubles réflexes du transit (dilatation aigüe de l'estomac) ;
- occlusion : la fixation indolore d'une larve dans l'iléon va entraîner la constitution en quelques semaines d'un granulome éosinophile dont les dimensions peuvent être telles qu’il peut provoquer un iléus. La nécrose de cette formation peut aussi conduire à des abcès septiques ou provoquer des symptômes évoquant la maladie de Crohn.
Le diagnostic peut être fait par une fibroscopie gastrique qui permet de visualiser et d’extirper des larves de 2 centimètres, ou par l'examen anatomopathologique du tissu prélevé par une biopsie ou au cours d’une intervention chirurgicale. L'examen anatomopathologique de pièces opératoires (granulome à éosinophiles) ne peut toutefois fournir qu'une orientation diagnostique, les parasites étant souvent dilacérés et vus en section sur les coupes.
On pense que les humains courent davantage de risque de contracter l'anisakiase en consommant des poissons sauvages que des poissons élevés dans des fermes aquacoles, parce que le procédé de broyage utilisé pour la fabrication des granulés servant de nourriture aux poissons d’élevage tue les parasites. Une étude faite en 2003 par la FAO de l’ONU n'a trouvé aucun parasite chez les saumons d’élevage, contrairement aux saumons sauvages parmi lesquels les parasites ont été fréquemment retrouvés.
Le nombre de cas confirmés par la découverte de larves est de plus de 2 500 par an au Japon, pays industrialisé le plus touché. Aux États-Unis, l'incidence serait de 10 cas par an. En Europe, les pays où l'anisakiase est communément rapportée sont l'Espagne, la Norvège, les Pays-Bas et le Royaume-Uni. L'incidence exacte est difficile à connaître, mais semble être de moins de 20 cas par pays et par an. En France, un rapport de l'InVS estimait en 1990 l'incidence à 8 cas par an.
Beaucoup de pays recommandent que tous les types de poissons présentant un risque à être consommés crus soient congelés pour tuer les parasites.
Réactions allergiques
Même lorsque le poisson est bien cuit, Anisakis demeure un risque pour la santé humaine. Les anisakidés et les espèces proches comme le ver de phoque ou ver de baleine (Pseudoterranova spp.) et le ver de morue (Hysterothylacium aduncum) libèrent des substances biochimiques, dont la principale est la paramyosine, dans les tissus qui les entourent lorsqu’ils infectent un poisson. Il arrive aussi qu’on consomme accidentellement ces produits, à l'intérieur d'un filet de poisson.
Les personnes sensibilisées aux nématodes peuvent, après avoir mangé du poisson infecté par Anisakis spp., présenter des manifestations allergiques allant de l’urticaire aux réactions anaphylactiques sévères, souvent confondues avec l’allergie au poisson ou aux coquillages, du fait que les composants allergéniques des anisakidés sont difficiles à tester et qu'il se produit souvent, lors des tests, des réactions positives avec d’autres allergènes ; des réactions croisées avec les autres parasitoses à Nématodes sont fréquemment observées.
Le diagnostic immunologique utilise le plus souvent des extraits larvaires d’Anisakis spp. La sensibilisation aux allergènes des anisakidés se traduit également par la présence d'IgE spécifiques. L'identification de l'anisakiase allergique et de la sensibilisation aux allergènes des Anisakis constitue un problème qui peut concerner une fraction importante de la population dans les pays où la consommation de poisson est importante (jusqu'à 14 % de prévalence dans certaines régions d'Espagne).
Traitement
Pour le ver, les humains sont une impasse parasitaire. Les larves d’Anisakis et de Pseudoterranova ne peuvent pas survivre chez l'humain et finissent par mourir. Le traitement est donc dans la grande majorité des cas purement symptomatique. La seule indication pour un traitement est une occlusion intestinale par les larves d’Anisakis, qui peuvent exiger une intervention chirurgicale d’urgence, bien qu'il y ait des observations de cas où le traitement par l’albendazole est parvenu à éviter la chirurgie (Pacios et al., 2005). Les benzimidazoles (albendazole[2], flubendazole, mébendazole) et l'ivermectine sont actifs sur les larves fixées à la paroi du tube digestif.
Prévalence
Les larves d’Anisakis sont des parasites répandus chez les poissons de mer (selon les espèces et les lieux de capture, de 15 à 100 % des poissons de mer seraient parasités) et anadromes (poissons qui vivent en mer mais se reproduisent en rivière, comme le saumon, les anguilles, et les éperlans), et elles peuvent également être retrouvées chez les céphalopodes, par exemple le calmar et la seiche (le taux d’infestation serait moindre, de l’ordre de 20 à 35 %). En revanche, ils sont absents chez les poissons vivant dans des eaux à basse salinité, à cause des exigences physiologiques des Euphausiidae, qui sont indispensables pour qu’elles accomplissent leur cycle parasitaire. Les Anisakis sont également rares dans les zones où les cétacés sont peu répandus, comme la partie méridionale de la mer du Nord (Grabda, 1976). En France, différentes enquêtes sur les poissons commerciaux les plus souvent consommés ont permis de retrouver des taux d’infestation de l’ordre de 80 % pour les anchois, 30 % pour les maquereaux, 70 % pour les merlans, 90 % pour les merlus et 60 % pour les chinchards.
Prévention
Pêche
Certaines conditions de pêche peuvent favoriser la contamination : lorsque le poisson est conservé à température ambiante, ou mal réfrigéré, les intestins se nécrosent en 6 à 8 heures, et les larves qui y sont éventuellement présentes migrent en direction des tissus avoisinants.
Industrie agroalimentaire
La prophylaxie collective de l'anisakiase est basée sur les principes définis dans le règlement CE/853/2004 du Parlement européen et du Conseil du :
- réfrigération rapide ou traitement (découpe puis congélation) des produits de la pêche sur les navires ;
- maintien de la chaîne du froid, inspection visuelle sur place et au laboratoire des produits livrés à la consommation, et congélation préalable des produits pour les restaurants servant du poisson cru.
Selon les normes américaines, les larves d'anisakidés sont détruites par congélation express à −35 °C, maintenue pendant au moins 15 heures, ou par congélation classique à −20 °C pendant au moins 7 jours. Selon le règlement CE/ 853/2004, 24 heures à −20 °C seraient suffisants.
Quelle que soit la norme, ces procédures n'inactivent pas les allergènes.
- Le chauffage à plus de 55 °C tue les larves en moins d'une minute, et dénature probablement certains allergènes (paramyosine).
- Une pression de 200 MPa pendant 10 min à une température comprise entre 0 et 15 °C tue les larves.
Compte tenu de l'aptitude des larves à la survie dans les solutions salines ou acides (vinaigre et citron), les techniques d'assainissement des denrées alimentaires devraient utiliser des concentrations de conservateur telles que le produit fini serait non conforme du point de vue organoleptique et de la salubrité.
Contrôle sanitaire des aliments
Dans les produits de la pêche, pour détecter les larves, la méthode de référence est l'examen de pièces, filets par exemple, par transillumination. La transparence des vers du genre Anisakis rend leur repérage difficile, en particulier si la chair du poisson est foncée ou si le morceau est épais. Ce n’est pas le cas pour le genre Pseudoterranova dont les larves ont une coloration plutôt foncée, rougeâtre.
Prévention individuelle
En général les larves sont présentes dans la cavité abdominale des poissons, enroulées en spirale, entourées par une capsule. Elles sont libres, ou plus souvent plaquées à la surface du mésentère et plus rarement dans le tissu musculaire. Elles ont de fortes capacités de survie aux températures négatives, dans les solutions salines et dans le vinaigre.
- La prophylaxie individuelle du parasitisme par les larves d'anisakidés repose sur la cuisson à cœur du poisson de mer frais.
- Pour les amateurs de poisson cru, il est conseillé la congélation pendant 7 jours dans un congélateur domestique. Une éviscération rapide du poisson après l’achat est conseillée. La découpe en tranches fines (carpaccio) plutôt qu'en tranches épaisses ou en cubes permet de détecter un éventuel parasitisme mais il faut préciser que la partie antérieure d’une larve d’Anisakis simplex coupée en 2 morceaux reste capable de pénétrer la paroi du tube digestif.
- Pour les individus souffrant d'allergie aux antigènes anisakiens, l'éviction alimentaire est la seule solution.
Règlementation
Règlement (CE) no 853/2004 du Parlement européen et du Conseil du (chapitres III et V).
Notes et références
- Gwenaël Vourc'h et al., Les zoonoses : Ces maladies qui nous lient aux animaux, Éditions Quæ, coll. « EnjeuxScience », (ISBN 978-2-7592-3270-3, lire en ligne), Qui nous transmet quoi et comment ?, « Les aliments : transmission par ingestion », p. 54, accès libre.
- (en) Pacios E, Arias-Diaz J, Zuloaga J, Gonzalez-Armengol J, Villarroel P, Balibrea JL, « Albendazole for the treatment of anisakiasis ileus », Clin Infect Dis, vol. 41, , p. 1825–6
- (en) Akbar A., Ghosh H., « Anisakiasis—a neglected diagnosis in the West », Allergy, vol. 37, no 1, , p. 7–9
- (en) Grabda, J., « Studies on the life cycle and morphogenesis of Anisakis simplex (Rudolphi, 1809)(Nematoda: Anisakidae) cultured in vitro », Acta Ichthyologica et Piscatoria, vol. 6, no 1, , p. 119–131
- (en) Lorenzo S, Iglesias R, Leiro J, Ubeira FM, Ansotegui I, Garcia M, Fernandez de Corres L, « Usefulness of currently available methods for the diagnosis of Anisakis simplex allergy », Allergy, vol. 55, , p. 627–33
- (en) Mattiucci S., Nascetti G., Tortini E., Ramadori L., Abaunza P. & Paggi L, « Composition and structure of metazoan parasitic communities of European hake (Merluccius merluccius) from Mediterranean and Atlantic waters: stock implications », Parassitologia, vol. 42, no S1, , p. 176–186
- (en) Orecchia P, Paggi L, Mattiucci S, Smith JW, Nascetti G & Bullini L, « Electrophoretic identification of larvae and adults of Anisakis (Ascaridida:Anisakidae) », J Helminthol, vol. 60, no 4, , p. 331–9