Acide du phosphore
Les acides du phosphore sont des composés de formule brute HxPyOzMq où M représente un hétéroatome pouvant être métallique, soufré ou halogéné. Quatre familles de composés caractérisent les acides du phosphore :
- la plus répandue et diversifiée est la famille des oxoacides du phosphore qui contiennent les fonctions hydroxyle (O-H), oxydes de phosphore (P=O) et phosphures d'hydrogène (P-H). Leur formule est du type HxPyOz. Un membre caractéristique de cette famille est l'acide phosphorique de formule H3PO4. Cette catégorie d'acides présente une chimie diversifiée et de nombreux domaines d'application (biologie, industrie, agriculture, etc.) ;
- celle des peroxoacides du phosphore (peroxophosphates protonnés) qui contiennent la fonction peroxyde. Ainsi ces composés exotiques se caractérisent par une forte réactivité ;
- celle des fluoroacides de phosphore de formule HxPyOzFq[1] (fluorophosphates protonnés). Ces composés ont la particularité d'être isostères d'acides communénent connus et utilisés ;
- celle des thioacides du phosphore de formule HxPySz. Toutefois l'existence de cette famille est transitoire, liée à une faible stabilité des acides en milieu aqueux[1].
Oxoacides
Propriétés et caractéristiques
Les oxoacides résultent de l'action de l'eau (hydrolyse) sur des oxydes de phosphore ou (anhydrides de phosphore) selon la réaction globale suivante :
- PxOy + nH2O → mHaPbOc
Un aspect intéressant est que les oxoacides du phosphore conservent certaines propriétés de leur anhydride correspondant, notamment le nombre d'oxydation du phosphore, la stabilité ou l'état physique dans les conditions standards thermodynamiques. Par exemple l'acide orthophosphorique (appelé acide phosphorique par abus de langage) est extrêmement stable et sa réduction en phosphore n'est possible que dans des conditions très agressives (avoisinant 1 000 °C[1]) avec des réducteurs très énergétiques (comme le carbone[1]) ; il en est de même pour son anhydride correspondant qui est l'hémipentoxyde de tétraphosphore P4O10 :
Tableau récapitulatif
| Catégorie de l'acide | Nombre d'oxydation du phosphore | Nom de l'acide | Formule brute | Structure | Anhydride correspondant |
|---|---|---|---|---|---|
| Hypophosphoreux | + I | Acide hypophosphoreux | H3PO2 | 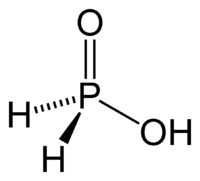 | Oxyde de diphosphore P2O (hypothétique) |
| Phosphoreux | + III | Acide métaphosphoreux | HPO2 | Hexoxyde de tétraphosphore P4O6 | |
| Acide pyrophosphoreux | H4P2O5 | 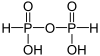 | |||
| Acide orthophosphoreux | H3PO3 | 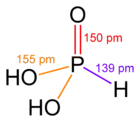 | |||
| Hypophosphorique | + IV | Acide hypophosphorique | H4P2O6 | 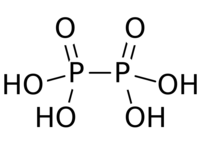 | Tétraoxyde de diphosphore P2O4 |
| Phosphorique | + V | Acide métaphosphorique | HPO3 | 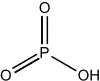 |
Hémipentoxyde de tétraphosphore P4O10 |
| Acide pyrophosphorique | H4P2O7 | 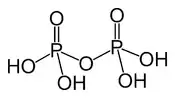 | |||
| Acide orthophosphorique | H3PO4 | 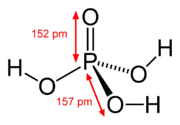 |
Les fluoroacides du phosphore HxPyOzFn
Définition
Un fluoroacide de phosphore est un oxoacide de phosphore où un ou plusieurs groupements hydroxyles sont substitués par un ou plusieurs atomes de fluor.
Théoriquement une ribambelle de fluoroacides du phosphore existent, mais expérimentalement seuls les fluoroacides phosphoriques (dérivés issus de l'acide ortho-phosphorique H3PO4) ont été caractérisés et isolés.
Préparation
La synthèse d'acides fluorophosphoriques comporte trois étapes :
1) La première étape consiste à totalement oxyder du phosphore blanc pour générer l'anhydride correspondant à l'acide ortho-phosphorique P4O10 :
2) La seconde étape consiste à mettre en contact P4O10 avec de l'acide fluorhydrique HF pour produire le trioxyfluorure de phosphore et l'acide ortho-phosphorique H3PO4) :
P4O10 + 6HF → 2POF3 + 2H3PO4
3) Pour finir, après avoir isolé le trioxyfluorure, celui-ci est hydrolysé et génère un mélange d'acide monofluorophosphorique H2PO3F et difluorophosphorique HPO2F2 dans de l'acide fluorhydrique HF :
Propriétés
Les acides fluorophosphorique ont la particularité d'être isostères (molécules caractérisées par le même nombre d'atomes et d'électrons de valence) d'acides communément utilisés et connus.
Typiquement l'acide monofluorophosphorique H2PO3F est isostère de l'acide sulfurique H2SO4 puisque ces deux composés comportent respectivement 7 atomes et 22 électrons de valence.
De manière équivalente, l'acide difluorophosphorique HPO2F2 est isostère de l'acide perchlorique (HO)ClO3 puisque ces deux composés comportent respectivement 6 atomes et 22 électrons de valence.
Utilisation
Les acides fluorophosphorique trouvent quelque applications quand ils sont sous forme de sels de fluorophosphates.
Par exemple, le monofluorophosphate de disodium Na2PO3F est un composé alcalin contenu dans les dentifrices; le rôle de ce dernier est d'assurer une protection contre les bactéries qui causent les caries.
Références
- A. Michel et J. Bénard, Chimie minérale - Généralités et étude particulière des éléments, Masson, 1964, 730 p., chap. D : « Le Phosphore, Combinaisons du phosphore avec l'oxygène ».
- R.B. Heslop et P.L. Robinson, Chimie Inorganique, Flammarion Médecine Sciences, , 822 p., page 472