Acide boronique
Un acide boronique est un acide borique substitué par un groupe alkyle ou aryle. Ces composés contiennent donc une liaison carbone-bore et appartiennent à la classe plus large des organoboranes.
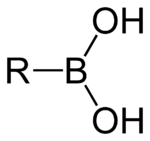
Les acides boroniques agissent comme des acides de Lewis. Leur caractéristique unique est qu'ils sont capables de former de façon réversible des complexes covalents avec les oses, les acides aminés, les acides hydroxamiques, etc., molécules possédant des groupes base de Lewis donneurs (alcool, amine, carboxylate) substitués (1,2) (vicinaux) ou occasionnellement (1,3). Le pKa des acides boroniques est en général proche de 9, mais certains peuvent former des boronates tétraédriques et ont un pKa d'environ 7.
Ils sont utilisés de façon occasionnelle dans le domaine de la reconnaissance moléculaire pour se lier à des saccharides pour la détection fluorescente ou le transport sélectif de saccharides à travers les membranes.
Les acides boroniques sont largement utilisés en chimie organique comme blocs de construction chimiques et intermédiaires, principalement dans le couplage de Suzuki. Un concept-clé dans leur chimie est la transmétallation de ses résidus organiques avec un métal de transition.
Le bortézomib qui possède un groupe acide boronique est un médicament utilisé en chimiothérapie. L'atome de bore de cette molécule est une sous-structure clé car à travers elle certains protéasomes qui dégraderait des protéines sont bloqués.
Acides boroniques
Beaucoup d'acides boroniques stables dans l'air sont disponibles dans le commerce. Une de leurs caractéristiques est leur haut point de fusion. Comme les acides boroniques perdent facilement une molécule d'eau pour former des anhydres trimériques, les échantillons vendus dans le commerce contiennent souvent ces anhydres, mais cela n'affecte pas leur réactivité.
| Acide boronique | R | masse molaire | numéro CAS | point de fusion (°C) | |
|---|---|---|---|---|---|
| acide phénylboronique | phényle | 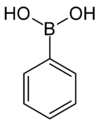 | 121,93 | 216–219 | |
| acide 2-thiénylboronique | thiophène | 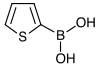 | 127,96 | 138–140 | |
| acide méthylboronique | méthyle | 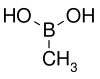 | 59,86 | 91–94 | |
| acide cis-propénylboronique | propène | 85,90 | 65–70 | ||
| acide trans-propénylboronique | propène | 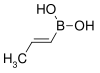 | 85,90 | 123–127 |
Synthèse
Les acides boroniques peuvent être obtenus par différentes méthodes. La méthode la plus commune est de faire réagir des composés organométalliques à base de lithium (organolithiens) ou de magnésium (réactifs de Grignard) avec des esters de borate[1] - [2] - [3] - [4]. Par exemple, l'acide phénylboronique est produit à partir du bromure de phénylmagnésium et du borate de triméthyle, suivie d'une hydrolyse[5] :
- PhMgBr + B(OMe)3 → PhB(OMe)2 + MeOMgBr
- PhB(OMe)2 + 2H2O → PhB(OH)2 + 2MeOH .
Une autre méthode est la réaction d'un arylsilane (RSiR3) avec le tribromure de bore (BBr3) dans une transmétallation en RBBr2 suivie par une hydrolyse en milieu acide.
Une troisième méthode est la réaction catalysée par le palladium d'un halogénure d'aryle et de triflates avec des esters de diboronyle par une réaction de couplage. Une alternative aux esters dans cette méthode est d'utiliser l'acide diboronique ou tétrahydroxydibore ([B(OH2)]2)[6] - [7].
Esters boroniques
Les esters boroniques ou esters de boronate sont les esters formés entre un acide boronique et un ou plusieurs alcools, ou un diol. L'acide phénylboronique peut se condenser sur lui-même pour former un trimère cyclique appelé anhydride de triphényle ou triphenylboroxine[8].
| Ester boronique | Diol | Formule structurelle | Masse molaire | numéro CAS | point d'ébullition (°C) |
|---|---|---|---|---|---|
| ester pinacolique de l'acide allylboronique | pinacol | 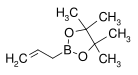 | 168,04 | 50–53 (5 mmHg) | |
| ester de trimethylene glycol de l'acide phénylboronique | triméthylène glycol | 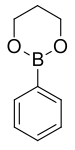 | 161,99 | 106 (2 mmHg) | |
| Diisopropoxyméthylborane | isopropanol | 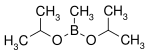 | 144,02 | 105-107 |
Les composés possédant un cycle à 5 contenant la série C-O-B-O-C sont appelés dioxaborolanes et ceux possédant un cycle à 6 dioxaborinanes.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Boronic acid » (voir la liste des auteurs).
- Boronic Acids. Edited by Dennis G. Hall 2005 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim (ISBN 3-527-30991-8)
- Example: Jesper Langgaard Kristensen, Morten Lysén, Per Vedsø, and Mikael Begtrup Günter Seidel and Alois Fürstner Published in Org. Synth. 2005, 81, 134 Org. Synth. 2009, Coll. Vol. 11, 1015 link
- Example: Quinoline, 3-(3-pyridinyl)- Wenjie Li, Dorian P. Nelson, Mark S. Jensen, R. Scott Hoerrner, Dongwei Cai, and Robert D. Larsen, Scott E. Denmark, Geoff T. Halvorsen, and Jeffrey M. Kallemeyn Published in Org. Synth. 2005, 81, 89 Org. Synth. 2009, Coll. Vol. 11, 393 Link
- Cyclopropanemethanol, 2-phenyl-, (1S-trans)- André B. Charette and Hélène Lebel Kevin Minbiole, Patrick Verhoest, and Amos B. Smith, III Published in Org. Synth. 1999, 76, 86 Org. Synth. 2004, Coll. Vol. 10, 613 Link
- Wahsburn, R. M.; Levens, E.; Albright, C. F.; Billig, F. A., Benzeneboronic anhydride, Org. Synth., coll. « vol. 4 », , p. 68
- Pilarski, L. T. and Szabó, K. J. (2011), Palladium-Catalyzed Direct Synthesis of Organoboronic Acids. Angewandte Chemie International Edition, 50: 8230–8232. DOI 10.1002/anie.201102384
- Palladium-Catalyzed, Direct Boronic Acid Synthesis from Aryl Chlorides: A Simplified Route to Diverse Boronate Ester Derivatives Gary A. Molander, Sarah L. J. Trice, Spencer D. Dreher Journal of the American Chemical Society 2010 132 (50), 17701-17703 DOI 10.1021/ja1089759
- Robert M. Washburn, Ernest Levens, Charles F. Albright, and Franklin A. Billig, Benzeneboronic Anhydride, Org. Synth., coll. « vol. 4 », , p. 68