Acide 4-formylphénylboronique
L'acide 4-formylphénylboronique (4-FPBA) est un composé chimique de formule OHC–C6H4–B(OH)2. Il se présente comme un solide blanc cristallisé sous forme d'aiguilles incolores[3] ou de poudre blanchâtre, faiblement soluble dans l'eau froide mais davantage dans l'eau chaude. Il est plutôt stable[4] et forme facilement des dimères et des anhydrides cycliques trimériques, ce qui en complique la purification et tend à faire perdre le groupe acide boronique à la suite d'une réaction de Suzuki[5]. C'est un précurseur important dans la synthèse de principes actifs agrochimiques et pharmaceutiques, et il trouve des applications industrielles comme stabilisant et inhibiteur enzymatique[6] ainsi que comme bactéricide.
| Acide 4-formyl-phénylboronique | |
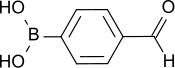
| |
| Structure de l'acide 4-formylphénylboronique | |
| Identification | |
|---|---|
| Nom UICPA | acide (4-formylphényl)boronique |
| No CAS | |
| No ECHA | 100.103.550 |
| No CE | 617-982-7, 438-670-5 |
| PubChem | 591073 |
| SMILES | |
| InChI | |
| Apparence | solide cristallisé incolore et inodore |
| Propriétés chimiques | |
| Formule | C7H7BO3 [Isomères] |
| Masse molaire[1] | 149,94 ± 0,014 g/mol C 56,07 %, H 4,71 %, B 7,21 %, O 32,01 %, |
| Propriétés physiques | |
| T° fusion | 256 à 257 °C[2] |
| Solubilité | 810,1 mg·L-1[2] à 20 °C |
| Précautions | |
| SGH[2] | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
La synthèse de l'acide 4-formylphénylboronique a été publiée en 1990 à partir de 4-bromobenzaldéhyde[3]. L'acétalisation du groupe aldéhyde a été réalisée par les méthodes standard à l'aide d'orthoformiate d'éthyle HC(OCH2CH3)3 et d'éthanol CH3CH2OH pour donner du 1-bromo-4-(diéthoxyméthyl)benzène. La formation du réactif de Grignard à partir de magnésium requiert du 1,2-dibromoéthane BrCH2CH2Br avec activation aux ultrasons. La réaction avec le tri-n-butylborate B(OCH2CH2CH2CH3)3 donne un ester arylboronique traité à l'acide pour donner l'acide 4-formylphénylboronique avec un rendement de 78 %.

Les mêmes réactifs peuvent produire, avec l'ester arylboronique à −60 °C, des kilogrammes d'acide 4-formylphénylboronique avec un rendement de 99 % lorsque la réaction est assistée avec du bis(2-méthoxyéthoxy)aluminohydrure de sodium NaAlH2(OCH2CH2OCH3)2[4].
Applications
L'acide 4-formylphénylboronique est utilisé dans des réactions de Suzuki, par exemple pour la production de biphényles pharmacologiquement actifs, comme précurseur du telmisartan[7] :
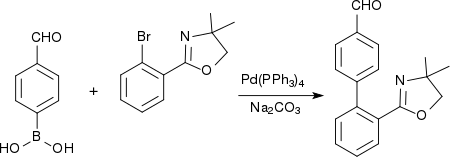
La synthèse de dérivés arylbenzimidazole peut également faire intervenir une liaison aryle-hétéroaryle à l'aide d'acide 4-formylphénylboronique en présence d'un catalyseur au palladium[8] :
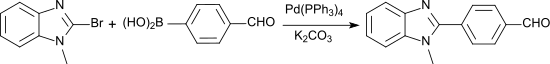
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « 4-Formylphenylboronic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 juillet 2017 (JavaScript nécessaire)
- (de) Herta Feulner, Gerald Linti et Heinrich Nöth, « Beiträge zur Chemie des Bors, 206. Darstellung und strukturelle Charakterisierung der p‐Formylbenzolboronsäure », European Journal of Inorganic Chemistry, vol. 123, no 9, , p. 1841-1843 (DOI 10.1002/cber.19901230915, lire en ligne)
- (en) Heiner Jendralla, Adalbert Wagner, Martina Mollath et Joachim Wunner, « Efficient, simple procedures for the large‐scale preparation of building blocks for angiotensin (II) receptor antagonists », European Journal of Organic Chemistry, vol. 1995, no 7, , p. 1253-1257 (DOI 10.1002/jlac.1995199507166)
- (en) G. K. Surya Prakash, Fabrizio Pertusati et George A. Olah, « HF-Free, Direct Synthesis of Tetrabutylammonium Trifluoroborates », Synthesis, vol. 2, , p. 292-302 (DOI 10.1055/s-0030-1258370, lire en ligne)
- (en) Xiaofeng Ji, Yuan Zheng, Wei Wang, Jun Sheng, Jianhua Hao et Mi Sun, « Virtual screening of novel reversible inhibitors for marine alkaline protease MP », Journal of Molecular Graphics and Modelling, vol. 46, , p. 125-131 (DOI 10.1016/j.jmgm.2013.10.004, lire en ligne)
- (en) A. Sanjeev Kumar, Samir Ghosh et G. N. Mehta, « Efficient and improved synthesis of Telmisartan », Beilstein Journal of Organic Chemistry, vol. 6, , article no 25 (PMID 20502601, PMCID 2874342, DOI 10.3762/bjoc.6.25)
- (en) Gagandeep Singh, Amanjot Singh, Varinder Singh, Raman K. Verma1and et Rajiv Mall, « Novel benzimidalzole derivatives as partial PPARγ agonists: synthesis, characterization and docing studies », Zorld Journal of Pharmacy and Pharmaceutical Sciences, vol. 5, no 7, , p. 1080-1091 (DOI 10.20959/wjpps20167-7143, www.wjpps.com/download/article/1467266773.pdf)