Tropinone
La tropinone est un alcaloïde, synthétisé magistralement en 1917 par Robert Robinson comme précurseur synthétique de l'atropine. Fait rare, il publia un article pendant la Première Guerre mondiale[4] - [5]. La tropinone comme la cocaïne et l'atropine montrent toutes la même structure de base tropanique.
| Tropinone | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | 8-méthyl-8-azabicyclo[3.2.1]octan-3-one |
| No CAS | |
| No ECHA | 100.007.756 |
| No CE | 208-530-6 |
| DrugBank | DB01874 |
| PubChem | 446337 |
| ChEBI | 16656 |
| SMILES | |
| InChI | |
| Apparence | plaquette cristalline incolore / poudre cristalline blanche, pratiquement poudre marron/brune[1] |
| Propriétés chimiques | |
| Formule | C8H13NO [Isomères] |
| Masse molaire[2] | 139,194 9 ± 0,007 8 g/mol C 69,03 %, H 9,41 %, N 10,06 %, O 11,49 %, |
| Propriétés physiques | |
| T° fusion | 41-44 °C[1] 42,5 °C |
| T° ébullition | 227 °C[1] décomposition |
| Masse volumique | 1,987 2 g·cm-3 à 100 °C[3] |
| Propriétés optiques | |
| Indice de réfraction | 1,4598 à 100 °C[3] |
| Précautions | |
| NFPA 704 | |
| Directive 67/548/EEC | |
 F |
|
| Unités du SI et CNTP, sauf indication contraire. | |
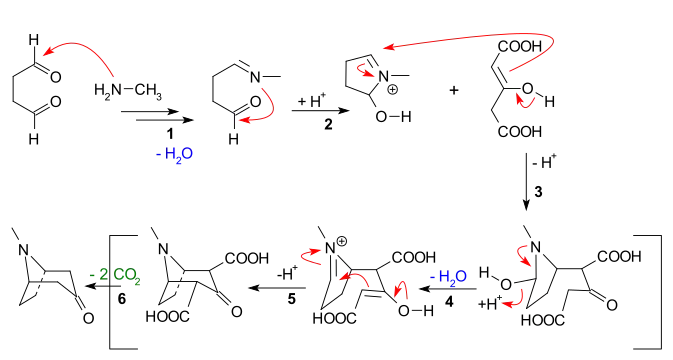
Synthèse
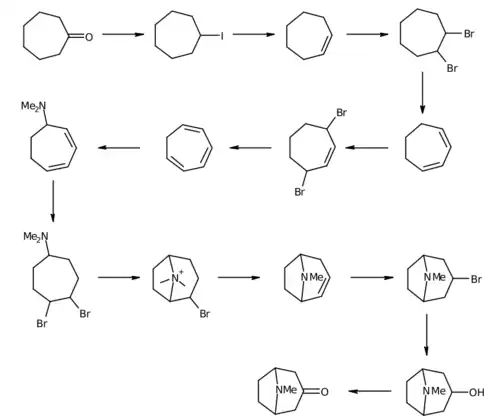
La première synthèse de la tropinone a été faite par Richard Willstätter en 1901. Il démarre avec un composé relativement homologue, la cycloheptanone mais sa voie de synthèse requiert beaucoup d'étapes et finalement, il a un rendement général de seulement 0,75 %[6]. R. Willstätter avait auparavant synthétisé la cocaïne depuis la tropinone, ce qui était la première synthèse et l'élucidation de la structure de la cocaïne[7].
La synthèse de 1917 de R. Robinson est considérée comme une synthèse totale légendaire[8] à cause de sa simplicité et de son approche biosynthétique. La tropinone est une molécule bicyclique mais les réactifs utilisés pour sa préparation sont relativement simples : succinaldéhyde, méthylamine et acide acétonedicarboxylique (ou même acétone). Cette synthèse est un bon exemple de réaction biomimétique (bionique) ou de "synthèse de type biogénétique" parce que la biosynthèse fait usage des mêmes blocs de synthèse. C'est aussi une réaction en tandem (en) dans une synthèse one-pot. De plus, le rendement de cette synthèse était de 17 % et avec les améliorations successives, de 90 %[6].
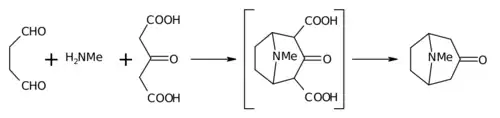
Mécanisme de la réaction
Les caractéristiques principales des réactions dans l'ordre sont :
- Addition nucléophile d'une amine secondaire sur un aldéhyde suivie de la perte d'eau qui crée une imine, équivalente à une amination réductrice ;
- Addition nucléophile intramoléculaire de l'imine sur l'autre aldéhyde et fermeture d'un premier cycle ;
- Réaction de Mannich intermoléculaire avec l'énol de l'acide acétonedicarboxylique ;
- Nouvelle formation d'énol puis d'une imine par perte d'eau ;
- Seconde réaction de Mannich intramoléculaire et fermeture du second cycle ;
- Retrait des deux groupes acide carboxylique qui donne la tropinone.
Notes et références
- [PDF] (en) fiche Tropinone chez Merck, consulté le 19/01/2011.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- a) David R. Lide, CRC Handbook of Chemistry and Physics, 90e Ed., (version internet: 2010), CRC Press/Taylor.
b) Francis, Boca Raton, FL, Physical Constants of Organic Compounds, pp. 3-336. - A synthesis of tropinone, R. Robinson; Journal of the Chemical Society, Transaction, 1917, vol. 111, p. 762–768. DOI 10.1039/CT9171100762
- The Art and Science of Total Synthesis at the Dawn of the Twenty-First Century, K. C. Nicolaou, Dionisios Vourloumis, Nicolas Winssinger, and Phil S. Baran; Angew. Chem. Int. Ed., 2000, vol. 39, p. 44.
- Smit, W. et al. (1998) Organic Synthesis, The Science behind the Art. Cambridge: The Royal Society of Chemistry.
- Tropane alkaloid biosynthesis. A century old problem unresolved., Andrew J. Humphrey and David O'Hagan; Natural Products Reports, 2001, vol. 18, p. 494-502. DOI 10.1039/b001713m
- Investigating a Scientific Legend: The Tropinone Synthesis of Sir Robert Robinson, F.R.S, Arthur J. Birch; Notes and Records of the Royal Society of London, 1993, vol. 47, p. 277-296.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Tropinone » (voir la liste des auteurs).
Annexes
Bibliographie
- M. Delépine, « Tropinone », dans Dictionnaire de chimie pure et appliquée, vol. 7, Paris, Librairie Hachette, (lire en ligne), p. 907