Tétryl
Le 2,4,6-trinitrophénylméthylnitramine ou N-méthyl-N,2,4,6-tétranitroaniline, de formule brute C7H5N5O8, communément appelé tétryl est un explosif puissant, mais sensible, toxique et instable dans le temps.
| Tétryl | |
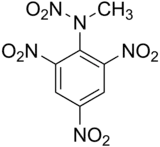
| |
| Formule et structure | |
| Identification | |
|---|---|
| Nom UICPA | N-méthyl-N,2,4,6-tétranitroaniline |
| Synonymes |
Nitramine |
| No CAS | |
| No ECHA | 100.006.848 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | Cristaux solides jaunes inodores |
| Propriétés chimiques | |
| Formule | C7H5N5O8 |
| Masse molaire | 287.15 g/mol |
| Propriétés physiques | |
| T° fusion | 129,5 °C |
| T° ébullition | 187 °C (temps de décomposition) |
| Solubilité | virtuellement insoluble |
| Masse volumique | 1,73 g/cm3 |
| Limites d’explosivité dans l’air | Vitesse de détonation = 7 570 m/s (sensible aux chocs, frictions, étincelles) |
| Précautions | |
| Directive 67/548/EEC | |
 T+  N |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Il a été utilisé dans la fabrication de détonateurs, comme explosif d'amorçage secondaire (petite charge placée à côté du détonateur dans le but de propager la détonation dans la charge explosive principale) et pour la production de charges d'explosif (dont pour des grenades sous-marine et « bombes rebondissantes »).
Son utilisation a été largement remplacée par le RDX.
Dans l'environnement, il est écotoxique et constitue un agent mutagène[1].
Histoire
Le tétryl, découvert et décrit par Romburgh en 1883[2], a principalement été utilisé durant la Première Guerre mondiale (comme propulseur, avec l'avantage que sa fabrication ne consommait pas les mêmes produits que de nombreux autres explosifs) et la Seconde Guerre mondiale et dans d'autres conflits leur ayant succédé. Malgré les précautions prises, notamment dans les années 1940, de nombreux ouvriers le manipulant ont été malades[2] ou victimes d'allergies[2].
Le tétryl était alors mélangé avec de l'acide stéarique, du graphite ou d'autres éléments de liaison pour qu'il puisse être pressé en pastilles, forme dans laquelle il a été le plus fréquemment utilisé dans des munitions[2]. Il est habituellement utilisé seul, mais il l'a parfois aussi été en association avec d'autres produits chimiques, par exemple dans le tétrytol.
Le tétryl n'est plus fabriqué ni utilisé aux États-Unis, mais peut encore être trouvé dans les « munitions héritées » ou munitions non-explosées ou des munitions immergées (dont mines anti-personnel M14[3]).
Propriétés physico-chimiques
Le tétryl est une nitramine. Il se présente comme un matériau cristallin jaune (poudre solide), dont la structure a été publiée depuis 1967 : il cristallise dans le système monoclinique, groupe d'espace P21/c avec comme paramètres de maille
- a = 1,4129 nm
- b = 0,7374 nm
- c = 1,0614 nm
- β = 97,07°
et 4 unités /maille[4].
Il est pratiquement insoluble dans l'eau mais soluble dans l'acétone, le benzène et d'autres solvants organiques. Lorsque le tétryl est chauffé, il fond d'abord, puis se décompose et explose.
Il brûle facilement et explose plus facilement que le picrate d'ammonium [5] ou le TNT, étant à peu près aussi sensible que l'acide picrique qu'il a souvent remplacé. L'explosion peut être initiée par frottement, par un choc ou une étincelle.
Bien conditionné, il reste stable à toutes les températures habituellement rencontrées sur les sites de stockage (dépôt d'explosif, dépôt de munition).
Usages
Il est généralement utilisé sous la forme de pastilles pressées, et a été approuvé comme charge standard d'éclatement pour les projectiles de petit calibre, car il produit une meilleure fragmentation que le TNT et son pouvoir brisant est plus important que ceux de tout autre explosif militaire de ce type.
Sa vitesse de détonation est de 7 200 - 7 300 mètres par seconde.
Le tétryl est utilisé dans les détonateurs nécessaires à la détonation du TNT. Il est alors lui-même amorcé par une capsule contenant un mélange de fulminate de mercure et de chlorate de potassium[5]. Il entre aussi dans la composition du tétrytol.
Stabilité et cinétique environnementale
Les munitions au tétryl contiennent des composés très toxiques, mais le 1,3,5-TNB (le plus toxique) est aussi le plus dégradable et biodégradable par les microorganismes du sol, dont les bactéries[6].
Ses résidus et certains produits intermédiaires de dégradation ou métabolites, par exemple l'aniline produite par les bactéries sufato-réductrices à partir de résidus de tétryl, sont donc toxiques ou écotoxiques. Mais ils sont réputés ne pas perdurer très longtemps dans la nature. On a longtemps supposé que ses impacts environnementaux se limitent aux zones qui en reçoivent de manière chronique.
Le tétryl se décompose rapidement en méthanol et en d'autres produits, en produisant de la chaleur. Tous les échantillons aqueux pouvant contenir du tétryl devraient être dilués avec de l'acétonitrile avant filtration et acidification (à pH <3). Tout échantillon pouvant contenir du tétryl ne doit pas être exposé à des températures supérieures à la température ambiante.
Le mode de dégradation varie selon qu'il se passe en milieu aérobie ou anaérobie[7]. En outre, ses produits de dégradation contiennent du 2,4,6-TNT[5].
Près d'un siècle après la première description de cette molécule par Romburgh en 1883, des toxicologues américains ont montré en 1980 que le tétryl s'avérait (à la différence d'autres explosifs tels que le PETN (pentaérythritol tétranitrate), le RDX (1,3,5-trinitrohexahydro-1,3,5-triazine) et le HMX (octahydro-1,3,5,7-tétranitro-1,3,5,7-tétrazocine)), être un puissant agent mutagène, agissant directement et à très faible dose[1] sur les trois systèmes microbiens classiquement utilisés pour les tests de mutagénicité (Neurospora crassa, Salmonella typhimurium et Saccharomyces cerevisiae)[1].
L'exposition humaine à ce produit et à ses produits de dégradation pourrait donc entraîner un risque pour la santé[1].
Production
Le tétryl est produit par mélange lent de diméthylaniline et d'acide nitrique, en présence d'acide sulfurique.
Toxicologie, écotoxicologie, Santé Environnementale
Le tétryl compte parmi les composés les plus toxiques et dangereux (explosif très puissant). Cripps en 1917[8], puis Wells, Lewis, Sansum, McClure et Lussky en 1920[9], Noro en 1941[10], Horner en 1942[11] et Witkowski, Fischer et Murdock en 1942[12] après avoir étudié les effets du tétryl sur la santé, ont tous conclu à une « toxicité systémique considérable »[13]. Durant la guerre, 30 % des travailleurs d'usines de munition en contact avec ce produit y étaient sensibilisés[13] en 10 à 14 jours en général[13]. Les travailleurs américains devaient utiliser des crèmes non grasses et se laver avec un savon à 1 % de sulfites qui décomposaient le tétryl[13]. Durant la seconde guerre mondiale, un nombre important d'allergies. Des dermatites de contact ont été constatées chez les ouvriers des usines de munitions, et notamment chez ceux qui manipulaient ou préparaient des explosifs ou qui manipulaient du fulminate de mercure. L'acide picrique (lyddite) et le trinitrotoluène (TNT) étaient des allergènes connus, mais le tétryl s'est montré plus allergène encore. Le mécanisme de ces allergies a été étudié durant cette période, sans déboucher sur des solutions de protection des ouvriers.
Sa courte durée de vie a fait croire qu'il ne posait pas de problème ou peu de problème.
Les impacts sanitaires et écotoxiques de ses produits de décomposition sont cependant largement ignorés (selon la littérature scientifique disponible). Il s'est par exemple avéré mutagène pour les microbes du sol et les espèces tests et pourrait peut-être l'être pour les animaux ou l'homme[13].
Références
- Whong Wen-Zong, Norman D. Speciner, Gordon S. Edwards, Mutagenic activity of tetryl, a nitroaromatic explosive, in three microbial test systems ; Toxicology Letters Volume 5, Issue 1, January 1980, Pages 11–17 (résumé)
- Leon J. Witkowski, M.D.; Carl N. Fisher, M.D.; Howard D. Murdock, M.S, Industrial illness due to tetryl report of 1258 cases ; AMA. 1942;119(17):1406-1409. doi: 10.1001/jama.1942.02830340018005 (Début du texte)
- “A Military Guide to Terrorism in the 21st Century.” August 2003. P. 171. U.S. Army Training and Doctrine Command, Fort Leavenworth, Kansas. http://smallwarsjournal.com/documents/terrorismhandbook.pdf. Accessed May 11, 2010.
- H. H. Cady, The crystal structure of N-methyl-N-2, 4, 6-tetranitroaniline (tetryl); Acta Crystallographica, 1967 scripts.iucr.org
- Boosters explosifs
- R Boopathy, Formation of aniline as a transient metabolite during the metabolism of tetryl by a sulfate-reducing bacterial consortium ;- Current microbiology, 2000 ([Résumé])
- Manish M. Shah, Jim C. Spain (1996), Regular Article Elimination of Nitrite from the Explosive 2,4,6-Trinitrophenylmethylnitramine (Tetryl) Catalyzed by Ferredoxin NADP Oxidoreductase from Spinach ; Biochemical and Biophysical Research Communications Volume 220, Issue 3, 27 March 1996, Pages 563–568 (Résumé)
- CRIPPS, L;-(1917) Brit. J. Derm., 29, 3.
- WELLS, H. G., LEWIS, J. H., SANSUM, W. D., MCCLURE, W. B., et LUSSKY, H. O.-(1920) J. industr. Hyg., 2, 247
- NORO, L.-(1943) Abstract in Bull. Hyg., 18, 223
- HORNER, S.-(1942) Proc. Roy. Soc. Med., 35, 701.
- WITKOWSKI, L. J., FISCHER, C. N., AND MURDOCK, H. D.-(1942) J. Amer. med. A88., 119, 1406.
- PGH Gell, Sensitization to “tetryl” ; National Institute for Medical Research, Hampstead ; British Journal of Experimental Pathology, 1944 [PDF] à partir de nih.gov
Voir aussi
Articles connexes
Liens externes
- (en) US-CDC, Tetryl Données sur le Tétryl, Agency for Toxic Substances and Disease Registry
- (en) Occupational Safety & Health Administration, USA, Occupational Safety and Health Guideline for Tetryl (Guide de sécurité, en anglais),
Bibliographie
- (en) Cooper, Paul W., Explosives Engineering, New York: Wiley-VCH, 1996. (ISBN 0-471-18636-8)