Pharmacorésistance
La pharmacorésistance, ou résistance aux médicaments, est la diminution progressive de l'efficacité d'un médicament tel qu'un antimicrobien ou un antinéoplasique dans le traitement d'une maladie ou d'un état[1]. Le terme est utilisé dans le contexte de la résistance que les agents pathogènes ou les cellules cancéreuses ont acquise. La résistance aux antimicrobiens et la résistance aux antinéoplasiques stimulent la recherche. Des organismes sont devenus résistants à plus d'un médicament ; ils sont multirésistant.
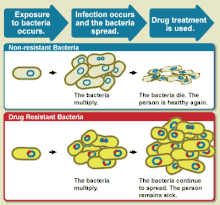
Le développement de la résistance aux antibiotiques provient notamment des médicaments ciblant des molécules bactériennes spécifiques (majoritairement des protéines). Si le médicament est spécifique, toute mutation dans ces molécules interfère ou annule son effet destructeur, entraînant une résistance aux antibiotiques. L'abus d'antibiotiques dans l'élevage, qui, dans l’Union européenne, représente trois fois le volume distribué aux humains, conduit au développement de bactéries résistantes.
Les bactéries sont capables de modifier l'enzyme cible des antibiotiques, mais également, par l'utilisation d'enzymes. Des exemples d'agents pathogènes modifiant la cible sont les Staphylococcus aureus, les entérocoques résistants à la vancomycine et le Streptococcus résistant aux macrolides ; des exemples de microbes modificateurs d'antibiotiques sont Pseudomonas aeruginosa et Acinetobacter baumannii résistant aux aminoglycosides.
Le manque d'efforts concertés des gouvernements et de l'industrie pharmaceutique, ainsi que la capacité innée des microbes à développer une résistance à un rythme qui dépasse le développement de médicaments, suggèrant que les stratégies existantes pour développer des thérapies antimicrobiennes viables à long terme sont voués à l'échec. Sans stratégies alternatives, l'acquisition de la résistance aux médicaments par des micro-organismes pathogènes apparaît comme une menaces de santé publique pour l'humanité du XXIe siècle. Certaines des sources alternatives pour réduire le risque de résistance aux antibiotiques sont les probiotiques, les prébiotiques, les fibres alimentaires, les enzymes, les acides organiques et les phytogéniques[2] - [3].
Types de résistances
La résistance aux médicaments, aux toxines ou aux produits chimiques est une conséquence de l'évolution et une réponse aux pressions imposées à tout organisme vivant. Les organismes individuels varient dans leur sensibilité au médicament utilisé et certains avec une plus grande forme physique peuvent être capables de survivre au traitement médicamenteux. Les traits de résistance aux médicaments sont hérités par la progéniture ultérieure, ce qui donne une population plus résistante aux médicaments. À moins que le médicament utilisé ne rende impossible la reproduction sexuée, la division cellulaire ou le transfert horizontal de gènes dans l'ensemble de la population cible, une résistance au médicament s'ensuivra. Cela peut être observé dans les tumeurs cancéreuses où certaines cellules peuvent développer une résistance aux médicaments utilisés en chimiothérapie[4]. La chimiothérapie amène les fibroblastes à proximité des tumeurs à produire des quantités de la protéine WNT16 B. Cette protéine stimule la croissance des cellules cancéreuses résistantes aux médicaments[5]. Il a été démontré que les microARN affectent la résistance acquise aux médicaments dans les cellules cancéreuses, ce qui peut être utilisé à des fins thérapeutiques[6]. En 2012, le paludisme est devenu une menace récurrente en Asie du Sud-Est et en Afrique subsaharienne, et les souches résistantes aux médicaments de Plasmodium falciparum posent des problèmes aux autorités sanitaires [7]. La lèpre a montré une résistance croissante à la dapsone.
Un processus rapide de partage de la résistance existe parmi les organismes unicellulaires et est appelé transfert horizontal de gènes dans lequel il y a un échange direct de gènes, en particulier à l'état de biofilm[8]. Une méthode asexuée similaire est utilisée par les champignons et est appelée « parasexualité ». Des exemples de souches résistantes aux médicaments se trouvent dans les micro-organismes [9] tels que les bactéries et les virus, les parasites endo- et ecto-, les plantes, les champignons, les arthropodes[10] - [11], les mammifères[12], les oiseaux[13], reptiles[14], poissons et amphibiens[14].
Dans l'environnement domestique, des souches d'organismes résistantes aux médicaments peuvent provenir d'activités apparemment sûres telles que l'utilisation d'eau de Javel[15], le brossage des dents et les bains de bouche[16], l'utilisation d'antibiotiques, de désinfectants et de détergents, de shampooings et de savons, en particulier les savons antibactériens[17], le lavage des mains[18], les sprays de surface, l'application de déodorants, de crèmes solaires et de tout produit cosmétique ou de soins de santé, les insecticides et les trempettes[19]. Les produits chimiques contenus dans ces préparations, en plus de nuire aux organismes bénéfiques, peuvent cibler intentionnellement ou par inadvertance des organismes susceptibles de développer une résistance[20].
Mécanismes
Les quatre principaux mécanismes par lesquels les micro-organismes présentent une résistance aux antimicrobiens sont[21] - [22] :
- Inactivation ou modification de médicaments : désactivation enzymatique de la pénicilline G dans certaines bactéries résistantes à la pénicilline par la production de β-lactamases ;
- Altération du site cible : altération du PBP - le site cible de liaison des pénicillines - dans le SARM et d'autres bactéries résistantes à la pénicilline ;
- Altération de la voie métabolique : certaines bactéries résistantes aux sulfamides ne nécessitent pas d'acide para-aminobenzoïque (PABA), un précurseur important pour la synthèse de l'acide folique et des acides nucléiques chez les bactéries inhibées par les sulfamides. Au lieu de cela, comme les cellules de mammifères, ils se tournent vers l'utilisation d'acide folique préformé ;
- Réduction de l'accumulation de médicaments : en diminuant la perméabilité des médicaments ou en augmentant l' efflux actif (pompage) des médicaments à travers la surface cellulaire.
Mécanismes de résistance acquise
| Mécanisme | Agent antibactérien | Action médicamenteuse | Mécanisme de résistance |
|---|---|---|---|
| Détruire la drogue | Aminoside
Antibiotiques bêta-lactamines (pénicilline et céphalosporine) Chloramphénicol |
Se lie à la sous-unité du ribosome 30S, inhibant la synthèse des protéines
Se lie aux protéines de liaison à la pénicilline, inhibant la synthèse des peptidoglycanes Se lie à la sous-unité du ribosome 50S, inhibant la formation de liaisons peptidiques |
Le plasmide code pour des enzymes qui altèrent chimiquement le médicament (par exemple, par acétylation ou phosphorylation), l'inactivant ainsi.
Le plasmide code pour la bêta-lactamase, qui ouvre le cycle bêta-lactame, l'inactivant. Le plasmide code pour une enzyme qui acétyle le médicament, l'inactivant ainsi. |
| Altère la cible médicamenteuse | Aminoglycosides
Antibiotiques bêta-lactamines (pénicilline et céphalosporine) Érythromycine Quinolones Rifampine Triméthoprime |
Se lie à la sous-unité du ribosome 30S, inhibant la synthèse des protéines
Se lie aux protéines de liaison à la pénicilline, inhibant la synthèse des peptidoglycanes Se lie à la sous-unité du ribosome 50S, inhibant la synthèse des protéines Se lie à l'ADN topoisomérase, une enzyme essentielle à la synthèse de l'ADN Se lie à l'ARN polymérase; inhibant l'initiation de la synthèse d'ARN Inhiber l'enzyme dihydrofolate réduit, bloquant la voie de l'acide folique |
Les bactéries fabriquent des ribosomes 30S modifiés qui ne se lient pas au médicament.
Les bactéries fabriquent des protéines modifiées de liaison à la pénicilline, qui ne se lient pas au médicament. Les bactéries fabriquent une forme de ribosome 50S qui ne se lie pas au médicament. Les bactéries fabriquent une ADN topoisomérase altérée qui ne se lie pas au médicament. Les bactéries fabriquent une polymérase altérée qui ne se lie pas au médicament. Les bactéries fabriquent une enzyme altérée qui ne se lie pas au médicament. |
| Inhibe l'entrée de drogue ou élimine la drogue | Pénicilline
Érythromycine Tétracycline |
Se lie aux protéines de liaison à la pénicilline, inhibant la synthèse des peptidoglycanes
Se lie à la sous-unité du ribosome 50S, inhibant la synthèse des protéines Se lie à la sous-unité du ribosome 30S, inhibant la synthèse des protéines en bloquant l'ARNt |
Les bactéries modifient la forme des protéines porines de la membrane externe, empêchant le médicament de pénétrer dans la cellule.
Le nouveau système de transport membranaire empêche le médicament de pénétrer dans la cellule. Un nouveau système de transport membranaire pompe le médicament hors de la cellule. |
Coût métabolique
Le coût biologique est une mesure de l'augmentation du métabolisme énergétique nécessaire pour accomplir une fonction.
La résistance aux médicaments a un prix métabolique élevé [23] chez les pathogènes pour lesquels ce concept est pertinent (bactéries[24], endoparasites et cellules tumorales. ) Dans les virus, un « coût » équivalent est la complexité génomique. Le coût métabolique élevé signifie qu'en l'absence d'antibiotiques, un agent pathogène résistant aura une aptitude évolutive réduite par rapport aux agents pathogènes sensibles[25].
Traitement
Chez l'homme, le gène ABCB1 code pour MDR1 (Glycoprotéine P) qui est un transporteur clé de médicaments au niveau cellulaire. Si MDR1 est surexprimé, la résistance aux médicaments augmente[26]. Par conséquent, les niveaux ABCB1 peuvent être surveillés[26]. Chez les patients présentant des niveaux élevés d'expression d'ABCB1, l'utilisation de traitements secondaires, comme la metformine, a été utilisée en conjonction avec le traitement médicamenteux primaire avec un certain succès[26].
Pour la résistance aux antibiotiques, qui représente un problème, des médicaments destinés à bloquer les mécanismes de résistance bactérienne aux antibiotiques sont utilisés. Par exemple, la résistance bactérienne aux antibiotiques bêta-lactamines (tels que la pénicilline et les céphalosporines ) peut être contournée en utilisant des antibiotiques tels que la nafcilline qui ne sont pas susceptibles d'être détruits par certaines bêta-lactamases (le groupe d'enzymes responsables de la dégradation des bêta-lactamines)[27]. La résistance bactérienne aux bêta-lactamines peut également être traitée en administrant des antibiotiques bêta-lactamines avec des médicaments qui bloquent les bêta-lactamases tels que l'acide clavulanique afin que les antibiotiques puissent agir sans être d'abord détruits par les bactéries[28]. Récemment, les chercheurs ont reconnu le besoin de nouveaux médicaments qui inhibent les pompes d'efflux bactériennes, qui provoquent une résistance à plusieurs antibiotiques tels que les bêta-lactamines, les quinolones, le chloramphénicol et le triméthoprime en envoyant des molécules de ces antibiotiques hors de la cellule bactérienne[29] - [30]. Parfois, une combinaison de différentes classes d'antibiotiques peut être utilisée en synergie; c'est-à-dire qu'ils travaillent ensemble pour combattre efficacement les bactéries qui peuvent être résistantes à l'un des antibiotiques seuls[31].
La destruction des bactéries résistantes peut également être obtenue par phagothérapie, dans laquelle un bactériophage spécifique (virus qui tue les bactéries) est utilisé[32].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Drug resistance » (voir la liste des auteurs).
- Alfarouk, Stock, Taylor et Walsh, « Resistance to cancer chemotherapy: failure in drug response from ADME to P-gp. », Cancer Cell International, vol. 15, , p. 71 (PMID 26180516, PMCID 4502609, DOI 10.1186/s12935-015-0221-1).
- (en) Jha, Das, Oak et Mishra, « Probiotics (Direct-Fed Microbials) in Poultry Nutrition and Their Effects on Nutrient Utilization, Growth and Laying Performance, and Gut Health: A Systematic Review », Animals, vol. 10, no 10, , p. 1863 (PMID 33066185, PMCID 7602066, DOI 10.3390/ani10101863)
- Jha et Mishra, « Dietary fiber in poultry nutrition and their effects on nutrient utilization, performance, gut health, and on the environment: a review », Journal of Animal Science and Biotechnology, vol. 12, no 1, , p. 51 (ISSN 2049-1891, PMID 33866972, PMCID 8054369, DOI 10.1186/s40104-021-00576-0, lire en ligne).
- « Tolerance and Resistance to Drugs », Merck Manuals Consumer Version
- "Chemo 'Undermines Itself' Through Rogue Response",BBC News, 5 August 2012.
- « MicroRNAs in cancer drug resistance: Basic evidence and clinical applications », Journal of Cellular Physiology, vol. x, no 3, , p. 2152–2168 (PMID 30146724, DOI 10.1002/jcp.26810, S2CID 52092652)
- Morelle, « Drug-resistant malaria can infect African mosquitoes », BBC News, (consulté le ).
- « Gene transfer occurs with enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure », Current Opinion in Biotechnology, vol. 14, no 3, , p. 255–61 (PMID 12849777, DOI 10.1016/S0958-1669(03)00036-3)
- « Mechanisms of drug action and resistance », tulane.edu
- « Ethion resistance in the cattle tick (Boophilus microplus) in New Caledonia. », International Journal of Pest Management, vol. 29, no 1, , p. 16–22 (DOI 10.1080/09670878309370763, lire en ligne)
- « Review Article on Colorado Potato Beetle Resistance to Insecticides », potatobeetle.org (consulté le )
- « Rodent resistance to the anticoagulant rodenticides, with particular reference to Denmark », Bulletin of the World Health Organization, vol. 47, no 5, , p. 611–8 (PMID 4540680, PMCID 2480843)
- « Repellency and toxicity of three bird control chemicals to four species of African grain-eating birds. », The Journal of Wildlife Management, vol. 46, no 2, , p. 453–7 (DOI 10.2307/3808656, JSTOR 3808656)
- « Reptiles Magazine, your source for reptile and herp care, breeding, and enthusiast articles » [archive du ], reptilechannel.com.
- « How household bleach works to kill bacteria », physorg.com.
- « Compete50 The complete mouth care products » [archive du ] (consulté le ).
- « Should antibacterial soap be outlawed? », HowStuffWorks, .
- « Use of germicides in the home and the healthcare setting: is there a relationship between germicide use and antibiotic resistance? », Infection Control and Hospital Epidemiology, vol. 27, no 10, , p. 1107–19 (PMID 17006819, DOI 10.1086/507964, S2CID 20734025).
- « Biochemical and molecular analysis of deltamethrin resistance in the common bed bug (Hemiptera: Cimicidae) », Journal of Medical Entomology, vol. 45, no 6, , p. 1092–101 (PMID 19058634, DOI 10.1603/0022-2585(2008)45[1092:BAMAOD]2.0.CO;2, S2CID 27422270).
- « Antibacterial cleaning products » [archive du ], Australian Department of Health & Human Services (consulté le ).
- (en) « Efflux-mediated drug resistance in bacteria: an update », Drugs, vol. 69, no 12, , p. 1555–623 (PMID 19678712, PMCID 2847397, DOI 10.2165/11317030-000000000-00000).
- (en) « Evolution of structural fitness and multifunctional aspects of mycobacterial RND family transporters », Archives of Microbiology, vol. 200, no 1, , p. 19–31 (PMID 28951954, DOI 10.1007/s00203-017-1434-6, S2CID 13656026).
- « The biological cost of antimicrobial resistance », Trends in Microbiology, vol. 5, no 9, , p. 337–9 (PMID 9294886, DOI 10.1016/S0966-842X(97)01101-3)
- « Biological cost of rifampin resistance from the perspective of Staphylococcus aureus », Antimicrobial Agents and Chemotherapy, vol. 46, no 11, , p. 3381–5 (PMID 12384339, PMCID 128759, DOI 10.1128/AAC.46.11.3381-3385.2002)
- Händel, Schuurmans, Brul et ter Kuile, « Compensation of the Metabolic Costs of Antibiotic Resistance by Physiological Adaptation in Escherichia coli », Antimicrobial Agents and Chemotherapy, vol. 57, no 8, , p. 3752–3762 (ISSN 0066-4804, PMID 23716056, PMCID 3719774, DOI 10.1128/AAC.02096-12)
- (en) « Effect of metformin on the survival of patients with ALL who express high levels of the ABCB1 drug resistance gene », Journal of Translational Medicine, vol. 16, no 1, , p. 245 (PMID 30176891, PMCID 6122769, DOI 10.1186/s12967-018-1620-6)
- « Penicillinase-resistant Penicillins and Cephalosporins », British Medical Journal, vol. 2, no 5405, , p. 344–9 (PMID 14160224, PMCID 1816326, DOI 10.1136/bmj.2.5405.344)
- « Beta-lactamase inhibitors from laboratory to clinic », Clinical Microbiology Reviews, vol. 1, no 1, , p. 109–23 (PMID 3060240, PMCID 358033, DOI 10.1128/CMR.1.1.109)
- « The importance of efflux pumps in bacterial antibiotic resistance », The Journal of Antimicrobial Chemotherapy, vol. 51, no 1, , p. 9–11 (PMID 12493781, DOI 10.1093/jac/dkg050)
- « Microbial efflux pump inhibition: tactics and strategies », Current Pharmaceutical Design, vol. 17, no 13, , p. 1291–302 (PMID 21470111, PMCID 3717411, DOI 10.2174/138161211795703726)
- « Comparative synergistic activity of nafcillin, oxacillin, and methicillin in combination with gentamicin against », Antimicrobial Agents and Chemotherapy, vol. 7, no 6, , p. 828–32 (PMID 1155924, PMCID 429234, DOI 10.1128/aac.7.6.828)
- (en) Lin, Koskella et Lin, « Phage therapy: An alternative to antibiotics in the age of multi-drug resistance », World Journal of Gastrointestinal Pharmacology and Therapeutics, vol. 8, no 3, , p. 162–173 (ISSN 2150-5349, PMID 28828194, PMCID 5547374, DOI 10.4292/wjgpt.v8.i3.162)
Voir aussi
Articles connexes
Liens externes
- BURDEN of Resistance and Disease in European Nations —Un projet de l'UE pour estimer le fardeau financier de la résistance aux antibiotiques dans les hôpitaux européens
- Merck - Tolérance et résistance
- Base de données cosmétiques
- Outil de mutations de résistance aux médicaments HCMV
- Combattre la résistance aux médicaments - Un article informatif sur la multirésistance aux médicaments
- Battle of the Bugs : Combattre la résistance aux antibiotiques
- MDRIpred : Un serveur Web pour prédire les inhibiteurs contre le M. Tuberculosis tolérant aux médicaments, publié dans Chemistry Central Journal
- CancerDR : Base de données sur la résistance aux médicaments anticancéreux.
- Rapports scientifiques 3, 1445