Persulfate de potassium
Le persulfate de potassium, aussi connu sous le nom de peroxodisulfate de potassium, est un composé inorganique de formule K2S2O8. Ce sel solide blanc très soluble dans l'eau est un oxydant puissant, couramment utilisé pour entamer une polymérisation.
| Persulfate de potassium | |||
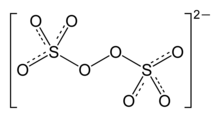  |
|||
| Formule développée du persulfate de potassium (en haut) et structure cristalline (en bas) | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | sulfonatooxy sulfate de dipotassium[1] | ||
| Synonymes |
peroxodisulfate de potassium |
||
| No CAS | |||
| No ECHA | 100.028.893 | ||
| No CE | 231-781-8 | ||
| No RTECS | SE0400000 | ||
| PubChem | 24412 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre cristalline incolore et inodore[2] - [1] | ||
| Propriétés chimiques | |||
| Formule | K2S2O8 | ||
| Masse molaire[3] | 270,322 ± 0,013 g/mol K 28,93 %, O 47,35 %, S 23,72 %, |
||
| Propriétés physiques | |||
| T° fusion | décomp. < 100 °C[2] - [1] | ||
| Solubilité | eau :17,5 g·l-1 à 0 °C[1] 52 g·l-1 à 20 °C[1] insol. dans l'éthanol[1] |
||
| Masse volumique | 2,477 g·cm-3[1] 2,48 g·cm-3 à 20 °C[2] |
||
| Cristallographie | |||
| Système cristallin | triclinique | ||
| Précautions | |||
| SGH[2] | |||
   |
|||
| Transport[2] - [1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 802 mg/kg (rat, oral)[4] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Préparation
Le persulfate de potassium peut être préparé par électrolyse d'une solution froide de bisulfate de potassium dans de l'acide sulfurique sous haute pression[5].
- 2 KHSO4 → K2S2O8 + H2
Il peut également être préparé par l'ajout de bisulfate de potassium (KHSO4) à une solution d'un sel plus soluble encore, le persulfate d'ammonium (NH4)2S2O8. En principe, il peut également être préparé par l'oxydation du sulfate de potassium par la fluorine.
Utilisations

Ce sel est utilisé pour amorcer la polymerisation de divers composés important pour le commerce comme le polytétrafluoroéthylène. En solution, le dianion se dissocie pour donner des radicaux[6]:
- [O3SO-OSO3]2− 2 [SO4]−
Il est utilisé en chimie organique comme agent d'oxydation[7].
Il est aussi utilisé comme agent de blanchissement, dans les teintures capillaires, avec le peroxyde d'hydrogène.
En tant qu'oxydant puissant, on l'utilise pour déterminer la quantité de composé azoté dans des échantillons d'eau par exemple[8].
C'est aussi un additif alimentaire codé (E)922 interdit dans l'Union Européenne.
Précautions
Oxydant puissant, il n'est pas compatible avec des composés organiques et peut donc être dangereux pour l'homme.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Potassium persulfate » (voir la liste des auteurs).
- PubChem CID 24412
- Entrée « Potassium persulfate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21/08/2015 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Persulfate de potassium », sur ChemIDplus.
- F. Feher, "Potassium Peroxydisulfate" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 392.
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a19_177.pub2), « Peroxo Compounds, Inorganic »
- Encyclopedia of Reagents for Organic Synthesis, vol. 1, p. 193-197(1995)
- Method 4500-N C. Persulfate Method for Total Nitrogen. In Standard Methods for the Examination of Water and Wastewater

