Oxyde de rhodium(IV)
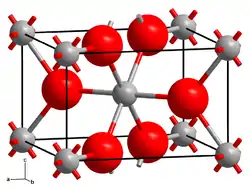
L’oxyde de rhodium(IV), ou dioxyde de rhodium, est un composé chimique de formule RhO2. Il s'agit d'un solide noir cristallisé dans le système tétragonal rutile[4] selon le groupe d'espace P42/mnm (no 136) avec les paramètres cristallins a = 448,9 pm, c = 309,0 pm et Z = 2[5]. Il en existe également un hydrate de couleur verte[3].
| Oxyde de rhodium(IV) | |
| |
| __ Rh4+ __ O2− Maille cristalline de l'oxyde de rhodium(IV). |
|
| Identification | |
|---|---|
| Nom UICPA | dioxorhodium |
| Nom systématique | Oxyde de rhodium(IV) |
| Synonymes |
dioxyde de rhodium |
| No CAS | |
| No ECHA | 100.032.021 |
| No CE | 235-237-0 |
| PubChem | 82936 |
| SMILES | |
| InChI | |
| Apparence | solide inodore[1] |
| Propriétés chimiques | |
| Formule | RhO2 |
| Masse molaire[2] | 134,904 3 ± 0,000 6 g/mol O 23,72 %, Rh 76,28 %, |
| Propriétés physiques | |
| Masse volumique | 7,2 g/cm3[3] |
| Cristallographie | |
| Système cristallin | tétragonal |
| Classe cristalline ou groupe d’espace | P42/mnm (no 136) |
| Paramètres de maille | a = 448,9 pm, c = 309,0 pm, Z = 2 |
| Unités du SI et CNTP, sauf indication contraire. | |
L'oxyde RhO2 est insoluble même dans l'eau régale chauffée[6]. Il peut être obtenu par oxydation de sulfate de rhodium(III) Rh2(SO4)3 avec par exemple de l'ozone O3 ou par électrolyse[7] :
L'oxyde de rhodium(IV) chauffé à l'air donne de l'oxyde de rhodium(III) Rh2O3 à 850 °C puis du rhodium métallique et de l'oxygène O2 à 1 050 °C[6].
Notes et références
- « Fiche du composé Rhodium(IV) oxide, Rh 75.2-77.4% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, « Properties of the Elements and Inorganic Compounds », CRC Handbook of Chemistry and Physics, 90e éd., Taylor & Francis, 2009, p. 4-85. (ISBN 978-1420090840)
- (en) R. D. Shannon, « Synthesis and properties of two new members of the rutile family RhO2 and PtO2 », Solid State Communications, vol. 6, no 3, , p. 139-143 (DOI 10.1016/0038-1098(68)90019-7, Bibcode 1968SSCom...6..139S, lire en ligne).
- (de) Jean D'Ans et Ellen Lax, Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, vol. 3, 4e éd., Springer, 1997, p. 698. (ISBN 978-3-5406-0035-0)
- (en) Olaf Muller et Rustum Roy, « Formation and stability of the platinum and rhodium oxides at high oxygen pressures and the structures of Pt3O4, β-PtO2 and RhO2 », Journal of the Less Common Metals, vol. 16, no 2, , p. 129-146 (DOI 10.1016/0022-5088(68)90070-2, lire en ligne).
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 102e éd., Walter de Gruyter, Berlin, 2007, p. 1702. (ISBN 978-3-11-017770-1)
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.


