Sulfate de rhodium(III)
Le sulfate de rhodium(III) est un composé chimique de formule Rh2(SO4)3. Il se présente comme un solide rouge-orangé cristallisé, dont il existe également des hydrates amorphes, un tétradécahydrate rouge et un pentadécahydrate jaune. Il présente une structure cristalline trigonale dans le groupe d'espace R3 (no 148)[4]. Il existe également un dihydrate orthorhombique du groupe d'espace Pnma (no 62)[1] ainsi que d'autres hydrates[5].
| Sulfate de rhodium(III) | |||
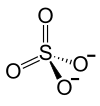 Ions constitutifs du sulfate de rhodium(III). |
|||
| Identification | |||
|---|---|---|---|
| No CAS | (tétrahydrate) |
||
| No ECHA | 100.030.909 | ||
| No CE | 234-014-5 | ||
| No RTECS | FF9335000 | ||
| PubChem | 159290 | ||
| SMILES | |||
| InChI | |||
| Apparence | substance pure solide rouge[1] ; distribué en solution à 5 %[2] | ||
| Propriétés chimiques | |||
| Formule | O12Rh2S3 |
||
| Masse molaire[3] | 493,999 ± 0,019 g/mol O 38,87 %, Rh 41,66 %, S 19,47 %, |
||
| Propriétés physiques | |||
| Masse volumique | 1,4 g/cm3[2] 20 °C | ||
| Précautions | |||
| SGH[2] | |||
 Danger |
|||
| NFPA 704[2] | |||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le sulfate de rhodium(III) peut être obtenu en faisant réagir de l'oxyde de rhodium(III) Rh2O3 ou de l'hydroxyde de rhodium(III) Rh(OH)3 avec de l'acide sulfurique H2SO4 pour donner le tétradécahydrate ou le pentadécahydrate selon les conditions de réaction[4] :
Le sulfate de rhodium(III) est un produit intermédiaire dans la production de rhodium et est utilisé pour la galvanoplastie avec du rhodium (placage au rhodium)[6] - [7].
Notes et références
- (en) Stefan Schwarzer, Annika Betke, Christian Logemann et Mathias S. Wickleder, « Oxidizing Rhodium with Sulfuric Acid: The Sulfates Rh2(SO4)3 and Rh2(SO4)3·2H2O », European Journal of Inorganic Chemistry, vol. 2017, no 3, , p. 752-758 (DOI 10.1002/ejic.201601247, lire en ligne).
- « Fiche du composé Rhodium(III) sulfate, bright plating solution, Rh 5% (cont. Rh) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Georg Brauer, Handbook of Preparative Inorganic Chemistry, Elsevier, 2012, p. 1589. (ISBN 978-0-323-16129-9)
- (en) Rudolf Warncke, Index Formula Index O-Zr Elements 104 to 132, Springer Science & Business Media, 2013, p. 106. (ISBN 978-3-662-09030-5)
- (de) Hans Martens et Daniel Goldmann, Recyclingtechnik Fachbuch für Lehre und Praxis, Springer-Verlag, 2016, p. 224. (ISBN 978-3-658-02786-5)
- (en) Gary J. K. Acres et Kurt Swars, Pt Platinum Supplement Volume A 1 Technology of Platinum-Group Metals, Springer Science & Business Media, 2013, p. 71. (ISBN 978-3-662-10278-7)

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://img.franco.wiki/i/574adab1409cb81da6c38bb738ad111e61bbb2d9.svg)
![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}} }](https://img.franco.wiki/i/cd32744e9f4314d390f5ee107a8bd812d0cc2da0.svg)

