Oxyde d'erbium(III)
L'oxyde d'erbium(III) ou erbine[6] est un oxyde du lanthanide erbium.
| Oxyde d'erbium(III) | |

| |
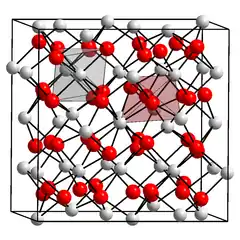 __ Er3+ __ O2− |
|
| Identification | |
|---|---|
| Nom UICPA | trioxyde de dierbium |
| Synonymes |
oxyde d'erbium, sesquioxyde d'erbium |
| No CAS | |
| No ECHA | 100.031.847 |
| No CE | 235-045-7 |
| No RTECS | KD9250000 |
| PubChem | 159426 |
| SMILES | |
| InChI | |
| Apparence | poudre rose |
| Propriétés chimiques | |
| Formule | Er2O3 |
| Masse molaire[1] | 382,516 ± 0,007 g/mol Er 87,45 %, O 12,55 %, |
| Propriétés physiques | |
| T° fusion | 2 344 °C[2] |
| T° ébullition | 3 920 °C[2] |
| Solubilité | 0,004 9 g·L-1 (eau, 24 °C)[3] |
| Masse volumique | 8,64 g·cm-3[3] |
| Cristallographie | |
| Système cristallin | cubique |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | Ia3 (no 206) |
| Précautions | |
| SGH[3] | |
 |
|
| NFPA 704[4] | |
| Écotoxicologie | |
| DL50 | > 5gm/kg (rat, oral)[5] |
| Unités du SI et CNTP, sauf indication contraire. | |
Historique
L'oxyde d'erbium(III) fut partiellement isolé par Carl Gustaf Mosander en 1843 mais obtenue sous forme pure seulement en 1905 par Georges Urbain et Charles James[7].
Propriétés
L'oxyde d'erbium(III) se présente sous la forme de poudre ou de cristaux roses. Il cristallise principalement sous forme cubique, mais sous certaines conditions, il prend une forme hexagonale[8]. Il est pratiquement insoluble dans l'eau, mais relativement soluble dans les acides minéraux. Er2O3 absorbe rapidement l'humidité et le dioxyde de carbone de l'atmosphère[8]
Une propriété intéressante des oxydes d'erbium est leur capacité à convertir l'énergie. L'oxyde d'erbium(III) absorbe en effet les rayonnements de faible énergie (infrarouge et visible de grande longueur d'onde) pour les convertir en rayonnement ultraviolet ou en lumière violette par de multiples transferts ou absorptions d'énergie[9]. Les nanoparticules d'oxyde d'erbium possèdent aussi des propriétés de photoluminescence. Ces nanoparticules peuvent être produites sous ultrasons (20 kHz, 29 W·cm−2) en présence de nanotubes de carbone multifeuillets.
Synthèse
L'oxyde d'erbium(III) peut être produit par combustion de l'erbium métallique dans l'air[10] :
Réactions
L'oxyde d'erbium(III) ragit avec les acides pour former les sels d'erbium(III) correspondant. Sa réaction avec l'acide chlorhydrique donne par exemple le chlorure d'erbium(III) :
- Er2O3 + 6 HCl → 2 ErCl3 + 3 H2O
Utilisations
Les applications de Er2O3 sont variées dues à leurs propriétés électriques, optiques, et de photoluminescence. Les matériaux nanométriques dopés par les ions Er+3 présentent un grand intérêt du fait que leurs propriétés électriques et optiques dépendent en grande partie de leur taille[11]. Des nanoparticules d'oxyde d'erbium dopées peuvent être dispersées dans de verres ou plastiques, par exemple dans les écrans. L'oxyde d'erbium fait partie des oxydes de terres rares les plus importants utilisés en biomedicine[12]. Les propriétés de photoluminescence des nanoparticules d'oxyde d'erbium sur les nanotubes de carbone les rendent utiles pour des applications biomédicales. Par exemple, de telles nanoparticules peuvent avoir leur surface modifiée en zones hydrophobes et hydrophiles en bioimagerie[11]. Les oxydes d'erbium sont aussi utilisés comme grille isolante dans les composés à semi-conducteurs, du fait de leur constante diélectrique élevée (10-14) et de leur large gap. L'erbium est parfois utilisé pour teinter les lunettes[13], et l'oxyde d'erbium peut être utilisé comme poison à neutrons consommable pour le combustible nucléaire.
Toxicité
L'oxyde d'erbium est toxique inhalé, pris oralement, ou injecté dans le flux sanguin à dose massive. Les effets à long terme de faibles concentrations sur les humains n'ont pas encore été déterminés[14].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, « Properties of the Elements and Inorganic Compounds », dans CRC Handbook of Chemistry and Physics, Boca Raton, FL, CRC Press/Taylor and Francis, , 90e éd., p. 63
- « Fiche du composé Erbium(III) oxide », sur Alfa Aesar (consulté le ).
- Fiche Sigma-Aldrich du composé Erbium(III) oxide, consultée le 19 mars 2015.
- Acute Toxicity Data. Journal of the American College of Toxicology, Part B. Vol. 12, Pg. 619, 1993.
- « Erbine », dans le Dictionnaire de l'Académie française, sur Centre national de ressources textuelles et lexicales
- (en) Aaron John Ihde, The development of modern chemistry, New York, Courier Dover Publications, , 378–379 p. (ISBN 0-486-64235-6, lire en ligne)
- M.P Singh, « Structural and electrical characterization of erbium oxide films grown on Si(100) by low-pressure metalorganic chemical vapor deposition », Applied Physics Letters, vol. 83, no 14, , p. 2889 (DOI 10.1063/1.1616653, lire en ligne [archive du ], consulté le )
- « Rare-earth-doped nanoparticles prove illuminating », SPIE (consulté le )
- (en) John Emsley, "Erbium" Nature's Building Blocks : An A-Z Guide to Elements., Oxford, England, Uk, Oxford University Press, , 136–139 p. (ISBN 0-19-850340-7, lire en ligne)
- Scheps Richard, « Upconversion laser processes », Progress in Quantum Electronics, vol. 20, , p. 271–358 (DOI 10.1016/0079-6727(95)00007-0, lire en ligne, consulté le )
- Skirtach Andre, Almudena Javier, Oliver Kref, Karen Kohler, Alicia Alberola, Helmuth Mohwald, Wolfgang Parak et Gleb Sukhorukov, « Laser-Induced Release of Encapsulated Materials inside Living Cells », Angew Chem Int. Ed, vol. 38, , p. 4612–4617 (lire en ligne, consulté le )
- (en) David Lide, Handbook of Chemistry and Physics, Boca, Raton Fl, CRC Press, , 4–57 p. (ISBN 0-8493-0594-2)
- « Erbium Biological Action » (consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Erbium(III) oxide » (voir la liste des auteurs).




