Oxamide
L'oxamide est un composé organique de formule chimique H2NOC–CONH2. Il s'agit du dérivé diamide de l'acide oxalique. Il se présente comme un solide blanc cristallisé soluble dans l'éthanol, faiblement soluble dans l'eau et insoluble dans l'éther diéthylique. On peut l'obtenir à partir du cyanure d'hydrogène HCN, oxydé en cyanogène N≡C–C≡N par l'oxygène en présence de nitrate de cuivre(II) ; l'addition de deux molécules d'eau sur le cyanogène donne de l'oxamide H2NOC–CONH2[3] :
| Oxamide | |
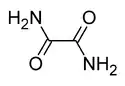 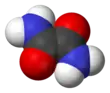 Structure de l'oxamide |
|
| Identification | |
|---|---|
| Nom UICPA | éthanediamide |
| Synonymes |
acide 1-carbamylformimidique, |
| No CAS | |
| No ECHA | 100.006.767 |
| No CE | 207-442-5 |
| No RTECS | RO4900000 |
| PubChem | 10113 |
| ChEBI | 48248 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C2H4N2O2 [Isomères] |
| Masse molaire[1] | 88,065 4 ± 0,002 9 g/mol C 27,28 %, H 4,58 %, N 31,81 %, O 36,34 %, |
| Propriétés physiques | |
| T° fusion | > 300 °C[2] |
| Précautions | |
| SGH[2] | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Une autre réaction fait intervenir le peroxyde d'hydrogène H2O2 :
L'oxamide est principalement utilisé comme substitut à l'urée CO(NH2)2 dans les engrais ; il libère de l'ammoniac NH3 très lentement par hydrolyse, ce qui est parfois préférable par rapport à l'hydrolyse rapide de l'urée.
Il est également utilisé pour stabiliser les préparations à base de nitrocellulose ainsi que comme inhibiteur de vitesse de combustion dans les moteurs-fusées à propergol composite à perchlorate d'ammonium haute performance : l'adjonction de 1 à 3 % massiques d'oxamide dans ces moteurs réduit la vitesse de combustion linéaire avec un faible impact sur l'impulsion spécifique du propergol solide.
Composé parent
L'oxamide est le composé parent de la famille des oxamides de formule générale (R1,R2)N-CO-CO-N(R3,R4). Les oxamides primaires de formule R1-NH-CO-CO-NH-R2 adoptent plus volontiers une conformation E(Z,Z) avec donc les amides en position Z -Les amides E (cis) ne sont rencontrés que dans des cycles lactames de moins de dix atomes[4]- ce qui permet la formation de cycles à 5 par liaison hydrogène tandis que les oxamides Z(Z,Z) sont déstabilisés par hyperconjugaison et gêne stérique entre les deux atomes d'hydrogène[5].
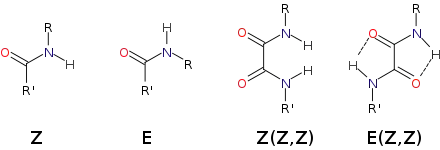
L'oxamide et plus généralement les oxamides sont de bons ligands bis(bidentate) pour former des complexes et des polymères inorganiques.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Oxamide 98%, consultée le 7 octobre 2013.
- (en) Wilhelm Riemenschneider, Minoru Tanifuji, « Oxalic Acid », Ullmann's Encyclopedia of Industrial Chemistry, (lire en ligne) DOI 10.1002/14356007.a18_247
- B. Dietrich, J.-M. Lehn, J.-P. Sauvage, J. Blauzat, Cryptates—X : Syntheses et proprietes physiques de systemes diaza-polyoxa-macrobicycliques, Tetrahedron, 1973, vol. 29(11), pp. 1629–1645. résumé en ligne.
- Synthèse et caractérisation d'aimants à précurseur moléculaire., Thèse de doctorat de J.-C. Colin, 1994, Université de Paris XI Orsay, p. 216.