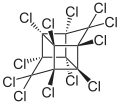
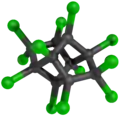
Mirex
Le mirex est un composé organochloré qui a été commercialisé comme retardateur de feu et comme insecticide puis interdit pour son impact environnemental. Ce solide, cristallin, blanc et inodore est un dérivé du cyclopentadiène. Il a été popularisé pour contrôler les fourmis de feu, mais en raison de sa robustesse chimique et de sa lipophilie, il a été reconnu comme un polluant bioaccumulable. Ironiquement, la propagation de la fourmi rouge importée et devenue invasive a été facilitée par l'utilisation de Mirex, car il tuait également les fourmis indigènes très compétitives avec les fourmis de feu. L'Environmental Protection Agency des États-Unis a interdit son utilisation en 1976[1]. Il est interdit par la Convention de Stockholm sur les polluants organiques persistants.
Production et applications
Le mirex a été synthétisé pour la première fois en 1946[2], mais n'a été utilisé dans les formulations de pesticides qu'en 1955. Le mirex a été produit par la dimérisation de l'hexachlorocyclopentadiène en présence de chlorure d'aluminium.
Le mirex est un insecticide pour l'estomac, ce qui signifie qu'il doit être ingéré par l'organisme pour l'empoisonner. L'utilisation insecticide était concentrée sur le sud-est des États-Unis pour contrôler les fourmis de feu importées Solenopsis saevissima richteri et Solenopsis invicta. Environ 250 000 kg de mirex ont été appliqués aux champs entre 1962 et 1975 (US NRC, 1978). La plupart du mirex se présentait sous la forme d'un « appât de mirex 4X », composé de 0,3 % de mirex dans 14,7 % d' huile de soja mélangée à 85 % de gruau de maïs. L'application de l'appât 4X a été conçue pour couvrir 4,2 g de mirex / ha et a été livrée par avion, hélicoptère ou tracteur. Des appâts 1x et 2x ont également été utilisés. L'utilisation du mirex comme pesticide a été interdite en 1978. La Convention de Stockholm a interdit la production et l'utilisation de plusieurs polluants organiques persistants, et Mirex fait partie des 12 polluants organiques persistants interdits par la Convention de Stockholm[3].
Dégradation
Le mirex ne brûle pas facilement (caractéristique des chlorocarbones) ; Les produits de combustion devraient inclure du dioxyde de carbone et plusieurs produits toxiques dont le monoxyde de carbone, le chlorure d'hydrogène, le chlore, le phosgène et d'autres espèces organochlorées.
Son oxydation lente produit du chlordécone (« Kepone »), un autre insecticide apparenté un peu moins difficilement dégradé, mais très reprotoxique et écotoxique et pour cette raison également interdit dans la plupart des pays occidentaux (avec dérogations pour la culture de la banane en outre-mer pour la France). La lumière du soleil dégrade le mirex principalement en « photomirex » (8-monohydromirex) et plus tard en partie en 2,8-dihydromirex[1] - [4] - [5]
Biodégradation
Le mirex est très résistant à la biodégradation. Il ne se déchlore que lentement en un dérivé monohydro- par action microbienne anaérobie dans les boues d'épuration et par les bactéries entériques.
La dégradation par les microorganismes du sol n'a pas été décrite.
Bioaccumulation et bioamplification
Le mirex est hautement cumulatif et sa quantité dépend de la concentration et de la durée de l'exposition.
Il existe des preuves d'accumulation de mirex dans les chaînes alimentaires aquatiques et terrestres à des niveaux nocifs.
Après 6 applications d'appâts de mirex à 1,4 kg/hectare, des taux élevés de mirex ont été retrouvés chez certaines espèces; la graisse de tortue contenait 24,8 mg de mirex/kg, les martins-pêcheurs, 1,9 mg / kg, la graisse de coyote, 6 mg / kg, la graisse d'opossum, 9,5 mg / kg et la graisse de raton laveur, 73,9 mg / kg. Bien après son interdiction il est encore retrouvé chez les mammifères marins, dauphins notamment[6] - [7].
Dans un écosystème modèle ayant une interface terrestre-aquatique, les semis de sorgo ont été traités avec du mirex à raison de 1,1 kg / ha. Les chenilles nourries de ces semis via leurs cadavres ou leurs fèces ont contaminé l'eau qui contenait des algues, des escargots, des daphnies, des larves de moustique et des poissons. Après 33 jours, le facteur de concentration écologique était de 219 pour les poissons et de 1165 pour les escargots.
Bien que les niveaux environnementaux généraux soient bas, cette molécule s'est répandue dans l'environnement biotique et abiotique et peut y être reconcentrée dans le réseau trophique. Étant lipophile, le Mirex est fortement adsorbé sur les sédiments riches en matière organique ou contenant des traces d'hydrocarbures. 30 à 45 ans après son interdiction il est encore présent dans les Grands Lacs en Amérique du Nord, de même que sa première molécules de dégradation dite "photomirex"[8] ; le taux de mirex contaminant a néanmoins chuté de 90 % de 1975 à 2010, mais de seulement de 75 % de 1993 à 2010 si l'on compte à la fois les quantités de mirex et de photomirex[8]. Il faudra probablement attendre 2030 pour ne plus le retrouver dans les poissons des Grands Lacs[8].
Sécurité
La toxicologie des molécules de la famille des dechloranes pour les mammifères n'est pas encore bien comprise[8], mais on estimait au début du XXIe siècle que le mirex n'est que modérément toxique dans les études sur des mammifères n'ayant reçu une seule dose (les valeurs de DL 50 par voie orale varient de 365 à 3 000 mg / kg de poids corporel)[9].
Il peut entrer dans le corps par inhalation, ingestion et passage percutané.
Les effets les plus sensibles d'expositions répétées chez l'animal de laboratoire sont principalement associés au foie et ils apparaissent à faible dose, dès 1,0 mg/kg de nourriture (0,05 mg/kg de poids corporel par jour), la plus faible dose testée. À des doses plus élevées, il est fœtotoxique (25 mg/kg dans l'alimentation) et tératogène (6,0 mg / kg par jour). Le Mirex n'était généralement pas actif dans les tests à court terme pour l'activité génétique. Il y a des preuves suffisantes de sa cancérogénicité chez la souris de laboratoire (et le rat). L'apparition retardée d'effets toxiques et de la mortalité sont typiques de l'empoisonnement par le mirex qui se montre hautement toxique cependant pour une large variété d'organismes aquatiques, les crustacés y étant particulièrement sensibles.
Le mirex induit des troubles physiologiques et biochimiques chroniques omniprésents chez divers vertébrés. Aucune dose journalière admissible (DJA) pour Mirex n'a été recommandée par la FAO ou l'OMS. Le CIRC (1979) a évalué le risque carcinogène du mirex et a conclu qu'« il existe des preuves suffisantes de sa cancérogénicité pour les souris et les rats ». En l'absence de données adéquates chez l'homme, on peut dire qu'il présente un risque cancérogène pour l'homme. Les données sur les effets sur la santé humaine n'existent pas.
Effets sur la santé
Selon un rapport de 1995 de l'ATSDR, le Mirex induit des changements du métabolisme graisseux dans les foies, une hyperexcitabilité et d'éventuelles convulsions, ainsi qu'une délétion de la reproduction chez les animaux. C'est un perturbateur endocrinien puissant, interférant avec les fonctions médiées par les œstrogènes (ex : ovulation, grossesse et croissance de l'endomètre y compris chez les animaux d'élevage exposés aux organochlorés via les aliments pour le bétail[10]. Il a également induit un cancer du foie par interaction avec des œstrogènes chez des rongeurs femelles[11].
Notes et références
- Robert L. Metcalf (2002) "Insect Control" in Ullmann’s Encyclopedia of Industrial Chemistry" Wiley-VCH, Wienheim | Doi:10.1002/14356007.a14_263
- H. J. Prins (1946). « Synthesis of Polychloro Combounds with Aluminium Chloride .XI.The Elimination of Hydrogen Chloride from Polychloro Combounds and the Formation of Cyclic Compounds -The Synthesis of Perchlorocyclopentadien ». Rec. Trav. Chim. 65 (7-8): 455–467. doi:10.1002/recl.19460650607.
- Kaiser KLE (1978) « Pesticide Report: The rise and fall of Mirex ». Environ. Sci. Technol. 12 (5): 520–528. doi:10.1021/es60141a005
- IPCS International (1990) Programme on Chemical Safety:Mirex – Health and Safety Guide No. 39
- Kelly L. Lambrych & John P. Hassett (2006) Wavelength-dependent photoreactivity of mirex in Lake Ontario, Environ. Sci. Technol., 40(3), 858–863; doi:10.1021/es0511927.
- Durante, C. A., Santos-Neto, E. B., Azevedo, A., Crespo, E. A., & Lailson-Brito, J. (2016). POPs in the South Latin America: Bioaccumulation of DDT, PCB, HCB, HCH and Mirex in blubber of common dolphin (Delphinus delphis) and Fraser's dolphin (Lagenodelphis hosei) from Argentina. Science of the Total Environment, 572, 352-360.
- Santos-Neto, E. B., Azevedo-Silva, C. E., Bisi, T. L., Santos, J., Meirelles, A. C. O., Carvalho, V. L., ... & Lailson-Brito, J. (2014). Organochlorine concentrations (PCBs, DDTs, HCHs, HCB and MIREX) in delphinids stranded at the northeastern Brazil. Science of the Total Environment, 472, 194-203.
- Gandhi N & al. (2015). Is mirex still a contaminant of concern for the North American Great Lakes ?. Journal of Great Lakes Research, 41(4), 1114-1122.
- EL-Bayomey AA, Somak IW & Branch S (2002). Embryotoxicity of the pesticide Mirex In vitro. Teratogenesis, Carcinogenesis, and Mutagenesis , 22:239-249.
- Wrobel, M. H., & Mlynarczuk, J. (2017). Secretory function of ovarian cells and myometrial contractions in cow are affected by chlorinated insecticides (chlordane, heptachlor, mirex) in vitro. Toxicology and applied pharmacology, 314, 63-71 | résumé.
- Faroon O, Kueberuwa S, Smith L, DeRosa C (1995). "ATSDR evaluation of health effects of chemicals. II. Mirex and chlordecone: health effects, toxicokinetics, human exposure, and environmental fate". Toxicol Ind Health. 11 (6): 1–203
Voir aussi
Articles connexes
- Polluant organique persistant
- Perturbateur endocrinien
- Chlordécone (l'un des produits de dégradation du Mirex)
Bibliographie
- Fiche Mirex de la base de données sur les propriétés des pesticides (Pesticide Properties DataBase ou PPDB))
- Organisation internationale pour la gestion des produits chimiques (IOMC), 1995, Rapport d'évaluation des POP, .
- Lambrych KL et JP Hassett. Photoréactivité dépendante de la longueur d'onde du mirex dans le lac Ontario. Environ. Sci. Technol. 2006, 40, 858-863
- Mirex Health and Safety Guide (Guide de santé et sécurité sur la Mirex). Programme international IPCS sur la sécurité chimique. Guide de santé et de sécurité n ° 39. 1990 (en)
- Revue toxicologique d'études sur le Mirex. À l'appui des informations sommaires sur le Système intégré d'information sur les risques (IRIS) 2003. US Environmental Protection Agency, Washington DC.
- Convention sur la pollution atmosphérique transfrontière à longue distance