Méthyltriméthoxysilane
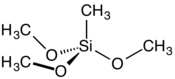
Le méthyltriméthoxysilane, ou triméthoxyméthylsilane, est un composé organosilicié de formule chimique (CH3O)3SiCH3. Il prend la forme d'un liquide incolore très inflammable à l'odeur fruitée qui se décompose au contact de l'eau. Sa molécule présente une géométrie tétraédrique. Il est utilisé notamment comme agent de réticulation lors de la production de polysiloxanes (silicones)[3] - [4].
| Méthyltriméthoxysilane | |
| |
| Structure du méthyltriméthoxysilane | |
| Identification | |
|---|---|
| Synonymes |
triméthoxyméthylsilane |
| No CAS | |
| No ECHA | 100.013.350 |
| No CE | 214-685-0 |
| No RTECS | VV4650000 |
| PubChem | 14456 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore très inflammables à l'odeur fruitée[1] |
| Propriétés chimiques | |
| Formule | C4H12O3Si |
| Masse molaire[2] | 136,221 8 ± 0,005 2 g/mol C 35,27 %, H 8,88 %, O 35,24 %, Si 20,62 %, |
| Propriétés physiques | |
| T° fusion | < −77 °C[1] |
| T° ébullition | 102 à 103 °C[1] |
| Solubilité | se décompose dans l'eau[1] |
| Masse volumique | 0,96 g·cm-3[1] à 20 °C |
| T° d'auto-inflammation | 238 °C[1] |
| Point d’éclair | 7,7 °C[1] |
| Pression de vapeur saturante | 2,99 kPa à 20 °C, 14,71 kPa à 50 °C[1] |
| Précautions | |
| SGH[1] | |
 Danger |
|
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 11,7 g/kg[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est généralement produit à partir de méthyltrichlorosilane CH3SiCl3 et de méthanol CH3OH :
L'alcoolyse des alkylchlorosilanes se déroule typiquement par substitution nucléophile SN2. Ce mécanisme favorise l'élimination de groupes partants comme les chlorures[5] et la rétention des alcoolates[6].
Notes et références
- Entrée « Trimethoxymethylsilane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2020 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) C. J. Brinker, « Hydrolysis and condensation of silicates: Effects on structure », Journal of Non-Crystalline Solids, vol. 100, nos 1-3, , p. 31-50 (DOI 10.1016/0022-3093(88)90005-1, Bibcode 1988JNCS..100...31B, lire en ligne)
- (en) Kazuyuki Kuroda, Atsushi Shimojima, Kazufumi Kawahara, Ryutaro Wakabayashi, Yasuhiro Tamura, Yusuke Asakura et Masaki Kitahara, « Utilization of Alkoxysilyl Groups for the Creation of Structurally Controlled Siloxane-Based Nanomaterials », Chemistry of Materials, vol. 26, no 1, , p. 211-220 (DOI 10.1021/cm4023387, lire en ligne)
- (en) Pawlenko Stephan, Organosilicon Chemistry, Walter de Gruyter, 1986. (ISBN 978-0899252025)
- (en) W. Ernest Colvin, Silicon in Organic Synthesis, Butterworth and Co Ltd, 1981. (ISBN 978-1483142234)
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.
