Hydrocarbonyle de cobalt
L'hydrocarbonyle de cobalt est un composé chimique de formule HCo(CO)4. Il se présente, entre −26,2 °C et −18 °C, sous la forme d'un liquide jaunâtre à l'odeur repoussante, instable thermiquement, qui se décompose à −18 °C[2] en octacarbonyle de dicobalt Co2(CO)8 et hydrogène H2[3] :
| Hydrocarbonyle de cobalt | |
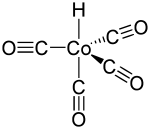 Structure de l'hydrocarbonyle de cobalt |
|
| Identification | |
|---|---|
| Synonymes |
tétracarbonyle d'hydrocobalt, |
| No CAS | |
| No ECHA | 100.290.757 |
| SMILES | |
| InChI | |
| Apparence | liquide jaunâtre thermiquement instable à l'odeur repoussante |
| Propriétés chimiques | |
| Formule | C4HCoO4 |
| Masse molaire[1] | 171,981 5 ± 0,004 5 g/mol C 27,93 %, H 0,59 %, Co 34,27 %, O 37,21 %, |
| Propriétés physiques | |
| T° fusion | −26,2 °C[2] |
| T° ébullition | décomposition à −18 °C[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est utilisé principalement comme catalyseur d'hydroformylation.
Propriétés
La molécule d'hydrocarbonyle de cobalt adopte une géométrie trigonale bipyramidale. Le ligand hydrure occupe l'une des positions axiales, de sorte que la molécule appartient au groupe de symétrie C3v[4]. La longueur des liaisons Co–CO et Co–H a été déterminée par diffraction d'électrons en phase gazeuse et s'établit respectivement à 176,4 pm et 155,6 pm[5]. Le nombre d'oxydation du cobalt dans cette molécule est +1.
Comme d'autres hydrures de carbonyles métalliques, HCo(CO)4 est acide, avec un pKa de 8,5[6]. Il peut être substitué par des phosphines tertiaires : ainsi, la triphénylphosphine PPh3 donne HCo(CO)3PPh3 et HCo(CO)2(PPh3)2, plus stables que HCo(CO)4 et par conséquent préférentiellement utilisés dans l'industrie[7] ; ces dérivés sont généralement moins acides que HCo(CO)4.
Production et utilisations
On prépare l'hydrocarbonyle de cobalt par réduction de l'octacarbonyle de dicobalt Co2(CO)8 avec un amalgame de sodium ou un réducteur semblable puis acidification du produit obtenu :
Dans la mesure où HCo(CO)4 se décompose très facilement, il est généralement produit in situ par hydrogénation du Co2(CO)8 :
Les paramètres thermodynamiques de cet équilibre ont été mesurés par spectroscopie infrarouge et s'établissent à ΔH = 4,054 kcal·mol−1 et ΔS = −3,067 cal·mol−1·K−1.
L'hydrocarbonyle de cobalt a été le premier hydrure de métal de transition utilisé industriellement[8]. Il a été démontré en 1953 que HCo(CO)4 est le catalyseur actif dans l'hydroformylation des alcènes, du monoxyde de carbone CO et de l'hydrogène H2 en aldéhydes[9]. Les catalyseurs au rhodium, plus chers mais plus efficaces, ont depuis largement supplanté les catalyseurs au cobalt dans ce type d'application, et la production mondiale d'aldéhydes en C3 à C8 à l'aide de catalyseurs au cobalt est d'environ 100 000 tonnes par an, soit environ 2 % du total.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Cobalt hydrocarbonyl » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 février 2013 (JavaScript nécessaire)
- (en) William J. Kerr, « Sodium Tetracarbonylcobaltate », Encyclopedia of Reagents for Organic Synthesis, (lire en ligne) DOI 10.1002/047084289X.rs105
- (en) John Dallas Donaldson et Detmar Beyersmann, « Cobalt and Cobalt Compounds », Ullmann's Encyclopedia of Industrial Chemistry, (lire en ligne) DOI 10.1002/14356007.a07_281.pub2
- (en) E. A. McNeill et F. R. Scholer, « Molecular structure of the gaseous metal carbonyl hydrides of manganese, iron, and cobalt », Journal of the American Chemical Society, vol. 99, no 19, , p. 6243-6249 (lire en ligne) DOI 10.1021/ja00461a011
- (en) Eric J. Moore, Jeffrey M. Sullivan et Jack R. Norton, « Kinetic and thermodynamic acidity of hydrido transition-metal complexes. 3. Thermodynamic acidity of common mononuclear carbonyl hydrides », Journal of the American Chemical Society, vol. 108, no 9, , p. 2257-2263 (lire en ligne) DOI 10.1021/ja00269a022
- (en) M. Pfeffer et M. Grellier, « 7.01 – Cobalt Organometallics », Comprehensive Organometallic Chemistry — III From Fundamentals to Applications, vol. 7, , p. 1-119 (lire en ligne) DOI 10.1016/B0-08-045047-4/00096-0
- (en) Peter Rittmeyer et Ulrich Wietelmann, « Hydrides », Ullmann's Encyclopedia of Industrial Chemistry, (lire en ligne) DOI 10.1002/14356007.a13_199
- (en) I. Wender, H. W. Sternberg et M. Orchin, « EVIDENCE FOR COBALT HYDROCARBONYL AS THE HYDROFORMYLATION CATALYST », Journal of the American Chemical Society, vol. 75, no 12, , p. 3041-3042 (lire en ligne) DOI 10.1021/ja01108a528
