GHK-Cu
Le peptide à cuivre GHK est un tripeptide de structure primaire Gly-L-His-L-Lys. C'est un chélateur naturel doté d'une grande affinité pour le cuivre(II) Cu2+. Le complexe qui en résulte est généralement noté GHK-Cu. Il a été isolé pour la première fois à partir de plasma humain, mais est également présent dans la salive et l'urine.
| Peptide à cuivre GHK | |
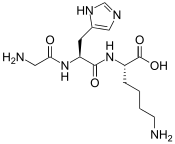 Structure du Gly-L-His-L-Lys (GHK) 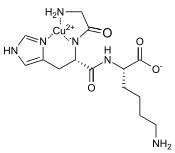 Structure du GHK complexé avec le cuivre |
|
| Identification | |
|---|---|
| Nom UICPA | glycyl-L-histidyl-L-lysine |
| Synonymes |
Gly-L-His-L-Lys |
| No CAS | (GHK) (GHK-Cu) |
| PubChem | 73587 (GHK) 71587328 (GHK-Cu) |
| ChEBI | 75430 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C14H24N6O4 [Isomères] |
| Masse molaire[1] | 340,378 2 ± 0,015 3 g/mol C 49,4 %, H 7,11 %, N 24,69 %, O 18,8 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Les peptides à cuivre sont généralement de petits fragments protéiques pourvus d'une grande affinité pour les cations de cuivre(II) Cu2+. Le taux plasmatique de GHK-Cu à l'âge de 20 ans est d'environ 200 µg ml−1, mais chute à 80 µg ml−1 à 60 ans. Chez l'homme, le GHK-Cu favorise la cicatrisation des plaies, stimule la synthèse du glycogène et du glycosaminoglycane dans les fibroblastes de la peau ainsi que la croissance des vaisseaux sanguins, possède des vertus anti-inflammatoires et anti-oxydantes, et attire les cellules du système immunitaire. Des études récentes ont montré qu'il peut moduler l'expression d'un grand nombre de gènes humains, généralement en rétablissant l'expression de ces gènes correspondant à l'état sain. Du GHK-Cu synthétique est utilisé dans les cosmétiques et comme ingrédient dans les produits dits « réparateurs » et « anti-âge »[2].
Lors d'études sur l'affinité du GHK pour le cuivre au cours desquelles le résidu d'histidine a été remplacé par un acide aminé synthétique, on a pu montrer que le résidu de glycine joue un rôle essentiel dans la liaison au cuivre, tandis que le résidu de lysine ne peut interagir avec le cuivre qu'à pH basique. À pH physiologique, la lysine peut interagir avec un récepteur cellulaire. La capacité du GHK à interagir à la fois avec le cuivre et avec un récepteur cellulaire lui permet de transporter le cuivre dans et hors des cellules. La petite taille de la molécule de GHK lui permet de circuler rapidement dans l'espace extracellulaire et d'accéder facilement aux récepteurs cellulaires[3].
La structure du complexe GHK-Cu a été étudiée en détail par cristallographie aux rayons X, résonance paramagnétique électronique, spectrométrie d'absorption des rayons X, spectroscopie RMN, ou encore par titrage. Dans ce complexe, le cation Cu2+ est coordonné à l'atome d'azote de l'imidazole de la chaîne latérale du résidu d'histidine, à l'atome d'azote du groupe amine α du résidu de glycine, et à l'atome d'azote de la liaison peptidique déprotonée entre les résidus de glycine et d'histidine. Dans la mesure où une telle structure ne permet pas d'expliquer la grande stabilité de ce complexe, dont le logarithme décimal de la constante de dissociation vaut log10(K) = 16,44, contre 8,68 pour le complexe GH-Cu, dont la structure est semblable à celle du complexe GHK-Cu, il a été avancé qu'un autre atome du GHK intervient pour stabiliser le complexe avec le cuivre. Il pourrait s'agir de l'atome d'oxygène du carboxyle du résidu de lysine[4].
De nombreux chercheurs ont proposé que les complexes GHK-Cu forment des dimères et des trimères à pH physiologique qui pourraient faire intervenir un résidu d'histidine et/ou la région de liaison au cuivre de la molécule d'albumine. La constante de dissociation du complexe formé avec le cuivre vaut log10(K) = 16,2 avec l'albumine plasmatique contre 16,44 avec le GHK.
L'activité rédox du cuivre(II) est neutralisée lorsqu'il est complexé avec le GHK, ce qui permet l'administration de cuivre non toxique aux cellules[5].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Loren Pickart, « The human tri-peptide GHK and tissue remodeling », Journal of Biomaterials Science, Polymer Edition, vol. 19, no 8, , p. 969-988 (PMID 18644225, DOI 10.1163/156856208784909435)
- (en) Chiara Conato, Riccardo Gavioli, Remo Guerrini, Henryk Kozl̵owski, Piotr Ml̵ynarz, Claudia Pasti, Fernando Pulidori et Maurizio Remelli, « Copper complexes of glycyl-histidyl-lysine and two of its synthetic analogues: chemical behaviour and biological activity », Biochimica et Biophysica Acta (BBA) - General Subjects, vol. 1526, no 2, , p. 199-210 (PMID 11325542, DOI 10.1016/S0304-4165(01)00127-1, lire en ligne)
- (en) Christelle Hureau, Hélène Eury, Régis Guillot, Christian Bijani, Stéphanie Sayen, Pier-Lorenzo Solari, Emmanuel Guillon, Peter Faller et Pierre Dorlet, « X-ray and Solution Structures of CuIIGHK and CuIIDAHK Complexes: Influence on Their Redox Properties », Chemistry - A European Journal, vol. 17, no 36, , p. 10151-10160 (PMID 21780203, DOI 10.1002/chem.201100751, lire en ligne)
- (en) S. J. Lau et B. Sarkar, « The interaction of copper(II) and glycyl-L-histidyl-L-lysine, a growth-modulating tripeptide from plasma », Biochemical Journal, vol. 199, no 3, , p. 649-656 (PMID 7340824, PMCID 1163421, lire en ligne)