Gènes de segmentation
Les gènes de segmentation sont des gènes zygotiques intervenant dans l'expression du programme génétique du développement embryonnaire des organismes invertébrés et vertébrés.
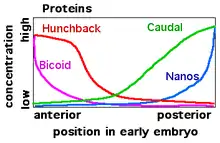
Drosophila melanogaster est l’organisme modèle chez qui les gènes de segmentations sont les mieux étudiés. Pour cette espèce, l’expression des gènes de segmentation est activée par des morphogènes maternels, présents dans l’œuf, qui sont à l'origine de la formation de l’axe de développement de l'embryon (antéro-postérieur). Les produits de ces morphogènes maternels incluent les protéines bicoid et hunchback qui sont concentrées dans la partie antérieure de l’embryon et forment un gradient allant environ jusqu’au centre de l’embryon, puis nanos et caudal qui sont concentrés dans la partie postérieure et forment un gradient antagoniste à celui de bicoid et hunchback[1]. Après la mise en place des axes embryonnaires, les gènes de segmentation assurent la segmentation (ou métamérisation) de l'embryon syncytial, soit la territorialisation générale du corps de l’animal. Les gènes de segmentation sont également responsables de l’expression de gènes homéotiques spécifiques à chacun des segments, permettant que chaque segment ait une morphologie et fonction différente[2].
Il existe trois catégories de gènes de segmentation:
- les gènes gap sont responsables de la localisation d’expression des gènes pair-rule.
- les gènes pair-rule sont responsables de la mise en place des segments.
- les gènes de polarité segmentaire sont responsables, chez Drosophila melanogaster, de la délimitation des extrémités antérieures et postérieures des parasegments.
Les gènes de segmentation peuvent, avant ou pendant le développement embryonnaire, subir des mutations aboutissant par exemple à des anomalies cérébrales[3] ou anatomiques (comme la prise d’identité erronée d’un segment[4] ou des problèmes de développement tel que la scoliose[5]).
Les gènes de segmentations furent découverts par Christiane Nüsslein-Volhard et Eric Wieschaus en 1980, en étudiant les phénotypes de différentes mutations chez Drosophilia melanogaster et en émettant des théories à propos de l’effet de la mutation sur le développement[6]. L’identification subséquente des mécanismes à l’origine des fonctions de ces gènes de segmentation chez Drosophila melanogaster et de leur influence sur le développement, puis la découverte que plusieurs de ces gènes ou des homologues de ces gènes sont conservés chez tous les groupes d’invertébrés et de vertébrés étudiés, fit passer le champ d’étude de la biologie évolutive du développement d’une science descriptive basée sur l’observation à une science où la génétique et les techniques de biologie moléculaire ont une place importante[7].
Gènes de segmentation dans le contexte du développement de Drosophila melanogaster
Gènes Gap
Les gènes gap sont parmi les premiers gènes exprimés par l’embryon de Drosophila melanogaster[8], et ont la fonction d’établir des zones distinctes, via l’élaboration de gradients de facteurs d’expression exprimés par ceux-ci, afin de permettre l’expression ordonnée des gènes pair-rule et ainsi permettre le bon déroulement de la segmentation de l’organisme.
Dans la partie antérieure de l’embryon, le morphogène maternel bicoid, dont l’expression est inhibée dans la partie postérieure de l’embryon par nanos[9], régule l’expression de l’ARN ainsi que la traduction en protéines des gènes gaps via son homéodomaine pouvant lier l’ADN et l’ARN à des sites spécifiques associés aux gènes gap[10]. D’autres importants gènes maternels affectant l’expression des gènes gaps sont hunchback, nanos et caudal.
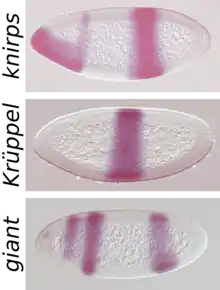
La protéine provenant du gène à effet maternel hunchback, à l’endroit où elle est le plus concentrée donc dans la partie la plus antérieure, empêche l’expression du gène gap giants, alors que bicoid active l’expression de giants, expliquant sa localisation dans une mince bande au tiers antérieure de l’embryon de Drosophila melanogaster. L’expression de giant dans le tiers postérieur de l’embryon est expliquée par l’action conjointe des protéines bicoid et caudal, caudal étant trop peu présent au centre de l’embryon et bicoid trop peu présent dans l’extrémité postérieure de l’embryon[11]. L’expression d’autres gènes gap comme krüppel, knirps et tailless est régulée de façon similaire via des concentrations relatives spécifiques des différents morphogènes maternels, qui sont disposés de façon précise dans l’œuf.
Gènes pair-rule

Les gènes pair-rule, les mieux étudiés étant even-skipped, hairy, odd-skipped et fushi tarazu, sont exprimés dans l’embryon syncytial en alternance dans quatorze bandes de taille équivalente en fonction de l’équilibre différentiel des concentrations des facteurs d’expression codés par les différents gènes gap. Donc les gènes gap divisent l’embryon en plusieurs sections, chacune contenant des concentrations relatives différentes des divers facteurs de transcription codés par les gènes gap, et ils causent l’expression de gènes pair-rule dans des zones spécifiques de taille restreinte[12].
L’expression des gènes pair-rule tels que even-skipped et de fushi tarazu dépend donc d’interactions complexes entre les différents gènes gap, et les gènes pair-rule peuvent également réguler entre eux leur expression[12]. De plus, une propriété intéressante du gène fushi tarazu est que le produit de son expression a l’effet de réguler positivement sa propre expression, causant une boucle de rétroaction positive, via la présence d’un homéodomaine dans la protéine fushi tarazu qui peut se lier à l’ADN de la séquence promotrice du gène[13] Ce mécanisme contribue au fait que l’expression de fushi tarazu soit très forte dans certaines bandes et très faibles dans les autres dominées par even-skipped, la présence de protéines even-skipped ayant un effet inhibiteur sur l’expression de fushi tarazu[12].
Les bandes ainsi formées par even-skipped et fushi tarazu délimitent les zones des futurs segments de Drosophilia melanogaster, et définiront les zones d’expression des gènes de polarité segmentaire. La période durant laquelle les gènes pair-rule sont le plus exprimés correspond à la période temporelle durant laquelle l’embryon va passer du stade d’un blastoderme syncytial, donc sans présence de paroi cellulaire pour séparer les noyaux, au stade d’un blastoderme cellulaire[2].
Gènes de polarité segmentaire
Les gènes de polarité segmentaire définissent les parties antérieures et postérieures des parasegments (zone entre les segments) de la drosophile, et causent l’expression spécifique d’homéogènes, notamment les gènes de la famille hox, qui fourniront à chaque segment une morphologie et fonction différente[2]. Les principaux genes de polarité segmentaire sont engrailed, gooseberry, hedgehog et wingless.
Le mécanisme expliquant comment l’expression des gènes de polarité segmentaire est régulée par les zones d’expression des différents gènes pair-rule est similaire à comment les gènes pair-rule sont régulés par les gènes gap. Une différence étant que l’étape de développement où les gènes de polarité segmentaire sont exprimés est lorsque l’embryon de Drosophila melanogaster est au stade de blastoderme cellulaire, ainsi il y a des parois entre les cellules donc les mécanismes de signalisation cellulaire impliquant l’activation de récepteurs membranaires, comme frizzled qui est un récepteur associé aux protéines G et répondant au ligand wingless. Wingless étant un gène dont l’expression est régulée positivement par le gène de polarité segmentaire gooseberry. Pour donner un exemple de régulation des gènes de polarité segmentaire par les gènes pair-rule : le gène pair-rule fushi tarazu inhibe l’expression de wingless[14] (donc l’effet est contraire à celui de gooseberry) et active l’expression de engrailed[15]. L’expression de engrailed est inhibée par le gène pair-rule odd-skipped, restreignant l’expression de engrailed que dans la partie antérieure des segments fushi tarazu[16].
Les principaux gènes activés par engrailed et gooseberry sont respectivement hedgehog et wingless, qui seront à l’origine de la différenciation des parties antérieures et postérieurs des segments de l’embryon. En règle générale, engrailed inhibe l’expression des gènes dont l’expression doit être dans la partie postérieure des segments, tel que wingless et patched, et gooseberry inhibe l’expression de gènes réservés à la partie antérieure des segments, tel que hedgehog, permettant ainsi de maintenir un gradient moléculaire bien défini à l’intérieur de chaque segment.

Comme la plupart des gènes, hedgehog est nommé en fonction de la plus évidente différence du phénotype, par rapport à un organisme type-sauvage, d’un organisme qui est mutant pour ce gène. Ainsi, une mouche à vinaigre Drosophila melanogaster dont le gène hedgehog a subi une mutation aura des segments recouverts de denticules, alors qu’une Drosophila melanogaster type-sauvage aura des denticules que sur la partie antérieure des segments, indiquant que hedgehog est principalement exprimée dans la partie postérieure des segments et influence négativement le développement de denticules.
Les protéines provenant des gènes de polarité segmentaires, en plus du fait que leur disposition en gradients moléculaires permet de fournir l’information sur le positionnement de chaque cellule dans l’espace d’un segment et qu’ainsi activent des gènes qui permettront le développement de la morphologie complexe de l’animal, ont également des effets plus directs sur celui-ci. Notamment, les gènes hedgehog, engrailed, gooseberry et patched, chacun étant exprimé en concentration différente dans les différentes rangées cellulaires du neuroectoderme de Drosophila melanogaster, sont essentiels au développement de son système nerveux central, en conférant aux cellules en position appropriés l’identité de neuroblastes, ainsi que la capacité de se diviser et de se différencier[17].
Gènes de segmentations chez d’autres animaux
Les gènes de segmentation sont décrits plus haut dans le contexte du développement de Drosophilia melanogaster, mais bien que leur fonctionnement soit moins bien compris, il existe des homologues de ces gènes qui ont un impact fort important sur le développement de tous les groupes d’animaux.
Chez les chordés, plutôt qu’une véritable segmentation, les organismes embryonnaires développent des somites de façon paire le long de leur axe rostro-caudal. Chaque paire de somites a une fonction développementale unique, selon sa position dans l’ordre de positionnement de celle-ci par rapport aux autres paires de somites. Elles sont notamment directement impliquées dans le développement des muscles, de la peau, des os et du système nerveux. Plusieurs des gènes impliqués dans la somitogenèse sont des homologues des gènes de segmentation étudiés chez la drosophile, notamment wingless et notch[18], et le gène pair-rule hairy[19]. L’oscillation temporelle de l’expression de ces gènes, du gène FGF (Fibroblast Growth Factor), et d’autres, serait à la base de la formation et de la prise d’identité des somites, tel que décrit par le modèle « Clock and wavefront » [18].
Le gène de polarité segmentaire engrailed a également été conservé durant l’évolution. Notamment, tôt dans l’évolution des mollusques, engrailed a acquis la fonction de délimiter la location du développement de la coquille, ce qui a été démontré par exemple chez les gastropodes[20] et les bivalves[21].
Le gène sonic hedgehog, qui est dans la même famille que le gène de polarité segmentaire hedgehog, a un important rôle dans l’acquisition d’identité de plusieurs éléments corporels des vertébrés. Chez les vertébrés, un gradient moléculaire de sonic hedgehog permet d’activer ou de réprimer l’expression de groupes de facteurs de transcriptions de façon différente selon la position de la cellule cible par rapport à la notochorde, puisque différentes concentrations de sonic hedgehog ont différents effets sur l’expression génétique[22]. Cela permet notamment la différenciation de la plaque basale (structure importante dans le développement du système nerveux centrale), des neurones moteurs[23], des membres[24] et des poumons[25]. Hedgehog participe aussi directement au guidage axonal lors du développement du cerveau[26].
Comme pour les arthropodes, le gène hedgehog a aussi un rôle important dans la segmentation des vers annélides[27], et les gènes hox, qui sont exprimés subséquemment à la délimitation des segments chez les arthropodes, sont directement responsables de la morphogenèse des membres de tous les animaux, incluant les vertèbres des organismes vertébrés[28].
Références
- (en) Christiane Nüsslein-Volhard, « Determination of the embryonic axes of Drosophila », Development, vol. 113, no Supplement 1, , p. 1–10 (ISSN 0950-1991 et 1477-9129, lire en ligne, consulté le )
- Lucas Sánchez et Denis Thieffry, « A Logical Analysis of the Drosophila Gap-gene System », Journal of Theoretical Biology, vol. 211, no 2, , p. 115–141 (DOI 10.1006/jtbi.2001.2335, lire en ligne, consulté le )
- Tara Alexander, Christof Nolte et Robb Krumlauf, « Hox Genes and Segmentation of the Hindbrain and Axial Skeleton », Annual Review of Cell and Developmental Biology, vol. 25, no 1, , p. 431–456 (PMID 19575673, DOI 10.1146/annurev.cellbio.042308.113423, lire en ligne, consulté le )
- Gary Struhl et Konrad Basler, « Organizing activity of wingless protein in Drosophila », Cell, vol. 72, no 4, , p. 527–540 (DOI 10.1016/0092-8674(93)90072-X, lire en ligne, consulté le )
- Olivier Pourquié, « Vertebrate Segmentation: From Cyclic Gene Networks to Scoliosis », Cell, vol. 145, no 5, , p. 650–663 (DOI 10.1016/j.cell.2011.05.011, lire en ligne, consulté le )
- Christiane Nüsslein-Volhard et Eric Wieschaus, « Mutations affecting segment number and polarity in Drosophila », Nature, vol. 287, no 5785, , p. 795–801 (DOI 10.1038/287795a0, lire en ligne)
- (en) Wallace Arthur, « The emerging conceptual framework of evolutionary developmental biology », Nature, vol. 415, no 6873, , p. 757–764 (ISSN 1476-4687, DOI 10.1038/415757a, lire en ligne, consulté le )
- (en) Christine Pfeifle, Diethard Tautz et Martin Hülskamp, « A morphogenetic gradient of hunchback protein organizes the expression of the gap genes Krüppel and knirps in the early Drosophila embryo », Nature, vol. 346, no 6284, , p. 577 (DOI 10.1038/346577a0, lire en ligne, consulté le )
- (en) F. Payre, M. Crozatier et A. Vincent, « Direct control of transcription of the Drosophila morphogen bicoid by the serendipity delta zinc finger protein, as revealed by in vivo analysis of a finger swap. », Genes & Development, vol. 8, no 22, , p. 2718–2728 (ISSN 0890-9369 et 1549-5477, PMID 7958928, DOI 10.1101/gad.8.22.2718, lire en ligne, consulté le )
- Dierk Niessing, Wolfgang Driever, Frank Sprenger et Heike Taubert, « Homeodomain Position 54 Specifies Transcriptional versus Translational Control by Bicoid », Molecular Cell, vol. 5, no 2, , p. 395–401 (DOI 10.1016/S1097-2765(00)80434-7, lire en ligne, consulté le )
- (en) C. Schulz et D. Tautz, « Zygotic caudal regulation by hunchback and its role in abdominal segment formation of the Drosophila embryo », Development, vol. 121, no 4, , p. 1023–1028 (ISSN 0950-1991 et 1477-9129, PMID 7743918, lire en ligne, consulté le )
- (en) M. Frasch et M. Levine, « Complementary patterns of even-skipped and fushi tarazu expression involve their differential regulation by a common set of segmentation genes in Drosophila. », Genes & Development, vol. 1, no 9, , p. 981–995 (ISSN 0890-9369 et 1549-5477, PMID 2892761, DOI 10.1101/gad.1.9.981, lire en ligne, consulté le )
- Alexander F. Schier et Walter J. Gehring, « Direct homeodomain–DNA interaction in the autoregulation of the fushi tarazu gene », Nature, vol. 356, no 6372, , p. 804–807 (DOI 10.1038/356804a0, lire en ligne)
- (en) Philip Ingham et Peter Gergen, « Interactions between the pair-rule genes runt, hairy, even-skipped and fushi tarazu and the establishment of periodic pattern in the Drosophila embryo », Development, vol. 104, no Supplement, , p. 51–60 (ISSN 0950-1991 et 1477-9129, lire en ligne, consulté le )
- Ken Howard et Philip Ingham, « Regulatory interactions between the segmentation genes fushi tarazu, hairy, and engrailed in the Drosophila blastoderm », Cell, vol. 44, no 6, , p. 949–957 (DOI 10.1016/0092-8674(86)90018-8, lire en ligne, consulté le )
- (en) S. DiNardo et P. H. O'Farrell, « Establishment and refinement of segmental pattern in the Drosophila embryo: spatial control of engrailed expression by pair-rule genes. », Genes & Development, vol. 1, no 10, , p. 1212–1225 (ISSN 0890-9369 et 1549-5477, PMID 3123316, DOI 10.1101/gad.1.10.1212, lire en ligne, consulté le )
- (en) Krishna Moorthi Bhat, « Segment polarity genes in neuroblast formation and identity specification during Drosophila neurogenesis », BioEssays, vol. 21, no 6, , p. 472–485 (ISSN 1521-1878, DOI 10.1002/(SICI)1521-1878(199906)21:63.0.CO;2-W, lire en ligne, consulté le )
- R. E. Baker, S. Schnell et P. K. Maini, « A clock and wavefront mechanism for somite formation », Developmental Biology, vol. 293, no 1, , p. 116–126 (DOI 10.1016/j.ydbio.2006.01.018, lire en ligne, consulté le )
- Isabel Palmeirim, Domingos Henrique, David Ish-Horowicz et Olivier Pourquié, « Avian hairy Gene Expression Identifies a Molecular Clock Linked to Vertebrate Segmentation and Somitogenesis », Cell, vol. 91, no 5, , p. 639–648 (DOI 10.1016/S0092-8674(00)80451-1, lire en ligne, consulté le )
- (en) Sharon M. Moshel, Michael Levine et J. R. Collier, « Shell differentiation and engrailed expression in the Ilyanassa embryo », Development Genes and Evolution, vol. 208, no 3, , p. 135–141 (ISSN 0949-944X et 1432-041X, DOI 10.1007/s004270050164, lire en ligne, consulté le )
- (en) David K. Jacobs, Charles G. Wray, Cathy J. Wedeen et Richard Kostriken, « Molluscan engrailed expression, serial organization, and shell evolution », Evolution & Development, vol. 2, no 6, , p. 340–347 (ISSN 1525-142X, DOI 10.1046/j.1525-142x.2000.00077.x, lire en ligne, consulté le )
- (en) Vanessa Ribes et James Briscoe, « Establishing and Interpreting Graded Sonic Hedgehog Signaling during Vertebrate Neural Tube Patterning: The Role of Negative Feedback », Cold Spring Harbor Perspectives in Biology, vol. 1, no 2, , a002014 (ISSN 1943-0264, PMID 20066087, DOI 10.1101/cshperspect.a002014, lire en ligne, consulté le )
- H Roelink, J. A Porter, C Chiang et Y Tanabe, « Floor plate and motor neuron induction by different concentrations of the amino-terminal cleavage product of sonic hedgehog autoproteolysis », Cell, vol. 81, no 3, , p. 445–455 (DOI 10.1016/0092-8674(95)90397-6, lire en ligne, consulté le )
- Robert D. Riddle, Randy L. Johnson, Ed Laufer et Cliff Tabin, « Sonic hedgehog mediates the polarizing activity of the ZPA », Cell, vol. 75, no 7, , p. 1401–1416 (DOI 10.1016/0092-8674(93)90626-2, lire en ligne, consulté le )
- (en) S. Bellusci, Y. Furuta, M. G. Rush et R. Henderson, « Involvement of Sonic hedgehog (Shh) in mouse embryonic lung growth and morphogenesis », Development, vol. 124, no 1, , p. 53–63 (ISSN 0950-1991 et 1477-9129, PMID 9006067, lire en ligne, consulté le )
- Frédéric Charron, Elke Stein, Juhee Jeong et Andrew P McMahon, « The Morphogen Sonic Hedgehog Is an Axonal Chemoattractant that Collaborates with Netrin-1 in Midline Axon Guidance », Cell, vol. 113, no 1, , p. 11–23 (DOI 10.1016/S0092-8674(03)00199-5, lire en ligne, consulté le )
- (en) Nicolas Dray, Kristin Tessmar-Raible, Martine Le Gouar et Laura Vibert, « Hedgehog Signaling Regulates Segment Formation in the Annelid Platynereis », Science, vol. 329, no 5989, , p. 339–342 (ISSN 0036-8075 et 1095-9203, PMID 20647470, DOI 10.1126/science.1188913, lire en ligne, consulté le )
- Robb Krumlauf, « Hox genes in vertebrate development », Cell, vol. 78, no 2, , p. 191–201 (DOI 10.1016/0092-8674(94)90290-9, lire en ligne, consulté le )