Hunchback (gène)
Le gène Hunchback (hb) est un gène de segmentation qui fait partie de la famille des gènes gap (en). Il intervient dans la formation des segments chez les arthropodes. Les gènes gap sont les premiers à s’exprimer parmi les gènes de segmentation. Les gènes sont souvent nommés par le phénotype des mutants, une mutation dans un gène gap entraine la perte d’un segment créant un « trou » (« gap » en anglais) dans le patron normal de développement, ainsi si le gène Hunchback est muté, les segments gnathaux et thoraciques seront absents, des défauts dans la formation de l’abdomen et du telson pourront aussi être observés. Les gènes gap codent des facteurs de transcription régulant l’expression des gènes pair-rule qui interviennent dans la mise en place des parasegments (correspondant à la partie antérieure d’un segment et à la partie postérieure d’un autre segment, les parasegments sont donc alternés). Si un gène pair-rule est muté, on observera une altération du phénotype normal sur la moitié des segments. Les gènes de polarité segmentaire sont les derniers gènes de segmentation à s’exprimer, ils permettent de mettre en place les limites antérieures et postérieures des segments. Les gènes de segmentation activent également des gènes homéotiques définissant l’identité de chaque segment.
Chez les insectes on distingue deux types de développement : les insectes holométaboles (métamorphose complète) et hétérométaboles (développement progressif ou métamorphose incomplète). L’apparition de la métamorphose est récente dans l’évolution. Les insectes holométaboles présentent donc des caractères évolués par rapport aux hétérométaboles. Pour comprendre comment les gènes impliqués dans ces deux types de développement ont évolué au cours du temps, il faut comparer différents organismes entre eux. Dans cette optique, beaucoup d’études en biologie évolutive du développement ont été réalisées pour comparer les expressions de différents gènes de développement chez plusieurs espèces afin de savoir quels sont les gènes qui sont conservés et de comprendre leur évolution au sein des arthropodes. Des comparaisons avec d’autres organismes proches des arthropodes tels que les nématodes et les annélides, ont aussi été réalisées afin de savoir comment les gènes ont évolué au cours de la divergence de ces deux groupes avec les arthropodes. Comparer les fonctions de ce gène avec des homologues chez les vertébrés, organismes présentant également une métamérie, permet de mieux comprendre comment les mécanismes permettant la métamérisation du corps ont évolué.
La drosophile, insecte holométabole, est un organisme modèle en biologie du développement, les mécanismes moléculaires intervenant au cours de son embryogenèse sont bien connus. C’est pourquoi de nombreuses études comparent l’expression des gènes de la drosophile à celle de gènes orthologues d’autres espèces.
Chez la drosophile, le gène Hunchback code un facteur de transcription possédant six domaines en doigt de zinc (sites de liaison à l’ADN) qui sont très conservés chez les insectes. Ce gène joue un rôle crucial dans la mise en place de l’axe antéro-postérieur.
Expression du gène Hunchback chez la drosophile
La segmentation de la drosophile est superficielle car les œufs sont centrolécithes (le vitellus est au centre de l’œuf), seuls les noyaux se divisent dans un cytoplasme commun (syncicium), on parle d’embryon syncicial. Les cellules s’individualisent en périphérie à la 14e division. La répartition des déterminants maternels (ARN provenant de la mère) va permettre la mise en place de l’axe antéro-postérieur au cours de la segmentation. Bicoid est présent côté antérieur et nanos est présent côté postérieur, l’ARNm maternel hunchback est réparti de façon homogène dans l’embryon. Les protéines Bicoid et Nanos sont réparties selon des gradients opposés dans l’embryon et inhibent respectivement l’expression de caudal dans la région antérieure et de hunchback dans la région postérieure [1]. Les gradients des protéines Hunchback, Caudal et Bicoid activent la transcription zygotique de plusieurs gènes gap le long de l’axe antéro-postérieur dont le gène Hunchback. Le gène hunchback agit donc principalement à l’état syncitial. Il est surtout exprimé dans la partie antérieure, au cours du développement, cette expression diminue et avant la gastrulation hb est également exprimé dans la partie postérieure de l’embryon [2]. Enfin, hb est exprimé dans les neuroblastes (cellules souches du système nerveux).
Hunchback code une protéine (protéine HB) qui est un facteur de transcription comportant six domaines en doigt de zinc : 4 au milieu de la protéine et 2 en position C-terminale. Sur l’ARNm se trouve un site de fixation pour la protéine Nanos appelé Nanos Response Element (NRE) situé dans la partie 3’UTR à 55 nucléotides du codon STOP.
Rôle du gène Hunchback chez la drosophile
La protéine HB a un rôle important dans la formation de la partie antérieure de l’animal et dans la segmentation de cette partie en agissant comme un morphogène en synergie avec Bicoid pour contrôler l’expression de plusieurs autres gènes.
Hunchback permet la formation des segments gnathaux, thoraciques, du labium et participe à la formation de plusieurs segments abdominaux [2].
Dans le système nerveux, les neuroblastes expriment successivement des facteurs de transcription qui permettront leur différenciation en cellules du systèmes nerveux [3]. Le premier facteur de transcription exprimé est HB qui va participer à la régulation des protéines POU (facteurs de transcription exprimés dans le système nerveux central)[4].
HB contrôle l’expression de plusieurs gènes gap tels que Krüppel pour lequel un faible taux de HB active son expression tandis qu’un fort taux la réprime, ce gène est donc exprimé dans la partie médiane de l’embryon ; les gènes Knirps et Giant qui sont réprimés dans la partie antérieure par HB ou encore Antennapedia. HB réprime également l’expression de Ultrabithorax (Ubx) [5] qui permet la différenciation des segments thoraciques et abdominaux. Ce gène est exprimé lorsqu’il y a peu de protéine HB donc dans la partie centrale de l’embryon. La protéine HB permet la formation d’un complexe qui réprime Ubx en agissant sur son promoteur proximal, empêchant ainsi à des activateurs de se fixer. La répression du gène Ubx par Hunchback intervient à un stade avancé dans le développement des embryons lorsque hb n’est plus nécessaire pour ses autres fonctions[5].
Hunchback permet la régulation de gènes Hox : la protéine dMI-2 se lie sur une région spécifique de la protéine HB et permet la répression des gènes Hox[6].
Des mutants pour le gène Hunchback peuvent être obtenus en mutant différentes régions codant chacun des doigts de zinc par exemple. Ils seront caractérisés par une absence des segments thoraciques et gnathaux et un labium absent, on observe donc une tête réduite. L’abdomen sera également déformé et si le deuxième doigt de zinc est délété ainsi que la D-box (une autre région du gène) on pourra observer la formation de segments abdominaux dans la région de la tête[7].
Comparaison avec d'autres espèces
Chez les insectes
Le stade de la bande germinale est le stade zootypique des insectes (ou stade phylotypique, stade de développement commun à tous les insectes). À partir de ce stade, il y a 3 types d’élongation de la bande germinale : courte, intermédiaire et longue. Chez les insectes à longue élongation, toutes les cellules le long de l’axe antéro-postérieur sont déjà spécifiées et se différencieront par la suite en cellules de la tête, du thorax ou de l’abdomen. Chez les insectes à développement court, seules les cellules de la partie antérieure sont spécifiées, les régions postérieures le seront plus tard dans le développement. Le mode d’élongation court représente la forme la plus ancestrale alors que le mode d’élongation longue, que l’on retrouve chez la drosophile, représente une forme évoluée de développement. Comparer ces modes de développement chez différentes espèces peut permettre de comprendre comment ont évolué les gènes impliqués dans ces mécanismes et comprendre comment au cours de l’évolution, les insectes sont passés d’un mode à l’autre.
Holométaboles
Chez Clogmia albipunctata, un diptère, l’homologue de hb a un rôle de gène gap similaire à celui de la drosophile [8]. Son expression diffère de celle de la drosophile parce que ce gène s’exprime dans une structure extra embryonnaire non présente chez la drosophile, la serosa ainsi que dans la région proctodéale [8] - [9]. L’expression dans la partie postérieure ne se fait qu’en début de gastrulation et est donc retardée par rapport à celle de la drosophile [8].
Chez le scarabée Tribolium castaneum (coléoptère), l’homologue du gène hunchback est exprimé maternellement dans tout l’embryon où son expression est régulée de la même façon que chez la drosophile. La protéine codée par ce gène porte 6 doigts de zinc et la séquence NRE est similaire à celle de la drosophile, située côté 3’ de l’ARNm également. L’expression zygotique permet le développement de la tête et des segments thoraciques. Hb participe de la même façon que chez la drosophile à la régulation de Krüppel. Il est également exprimé dans le système nerveux. A l’inverse de la drosophile, hunchback est exprimé dans la serosa comme chez Clogmia albipunctata. Dans la partie postérieure, l’expression de hb est réduite à 2 bandes d’expression alors qu’il n’y en a qu’une chez la drosophile et est plus tardive que chez la drosophile[10].
Tribolium castaneum se développe en ayant une élongation de la bande germinale courte et possède une serosa, deux caractéristiques ancestrales retrouvées aussi chez Clogmia albipunctata. En effet, les insectes plus basaux possèdent 2 tissus extra embryonnaires, l’amnion et la serosa alors que chez les insectes plus dérivés comme la drosophile, il n’y a qu’un seul tissu, l’amnioserosa [8]. Beaucoup d’insectes expriment hb dans la serosa, cette fonction a été perdue au cours de l’évolution dans la lignée des drosophiles. De même, l’expression de hb dans la partie postérieure se fait plus tardivement dans les lignées plus basales que la drosophile.
Hémimétaboles
Les insectes hémimétaboles font partie des hétérométaboles, leur métamorphose est incomplète et il y a un changement d’écologie entre la larve et l’adulte, c’est le cas par exemple des hémiptères et des orthoptères.
Chez Oncopeltus fasciatus, un hémiptère, l’homologue de hunchback est Of’hb. Ce gène code une protéine à 8 domaines en doigt de zinc : 2 en position N-terminale, 4 au centre de la protéine et 2 en position C-terminale. Les 6 derniers domaines sont homologues à ceux de la drosophile [11]. Les mêmes observations ont été faites en comparant hb à son homologue chez la sauterelle Schistocera americana et le criquet migrateur Locusta migratoria [12], deux orthoptères. Cela suggère qu’il y a eu perte des 2 domaines en position N-terminale au cours de l’évolution entre hémimétaboles et holométaboles passant ainsi de 8 domaines en doigt de zinc (état ancestral) à 6 domaines (état dérivé). Il serait alors intéressant de savoir quelles sont les fonctions des 2 domaines en position N-terminale afin de savoir quel rôle ils jouent dans le développement hémimétabole et pourquoi ils ne sont plus nécessaires pour un développement holométabole [11].
Of’hb, comme chez la drosophile, est exprimé maternellement, de façon homogène dans l’œuf. L’expression de Of’hb dans le blastoderme est semblable à celle de la drosophile mais au cours de l’élongation de la bande germinale, l’expression est similaire à celle des autres insectes à élongation courte. Il est également exprimé dans le système nerveux. Of’hb possède deux rôles : il supprime l’identité abdominale dans la région thoracique et gnathale de l’embryon et permet la segmentation de la bande germinale. Des mutants pour ce gène présentent des phénotypes similaires à ceux de mutants hb chez la drosophile [11].
Chez Schistocera americana, l’homologue à hb a le même rôle de gène gap dans la partie antérieure de l’embryon. Il est également exprimé de façon transitoire dans les neuroblastes [12]. Il participe aussi à la régulation de Ubx [12]. Comme chez la drosophile, on retrouve une séquence codant la région de fixation de dMI-2 sur la protéine HB [12], cette fonction a donc été conservée. L’homologue à hb s’exprime dans la serosa, ce qui est une caractéristique des insectes basaux. L’expression maternelle est différente de celle de la drosophile. En effet, chez la drosophile l’expression maternelle et zygotique de hb permet la mise en place de l’axe antéro-postérieur mais chez la sauterelle, l’expression maternelle joue un rôle dans la spécification des cellules qui formeront les tissus embryonnaires et extra-embryonnaires[12].
Chez Helobdella triserialis
Chez cette espèce de sangsue (annélide), lzf1 et lzf2 sont les gènes homologues à Hunchback[13].
Les séquences de hb et Lzf2 sont similaires. En effet, Lzf2 code une protéine de 468 acides aminés contenant 5 domaines en doigt de zinc : 3 dans la région N-terminale et 2 dans la région C-terminale de la protéine ce qui est similaire à ce que l’on retrouve chez la drosophile excepté qu’il y a 4 domaines au milieu de la protéine chez cette dernière. Les 3 domaines en position N-terminale sont très similaires aux 2e, 3e et 4e domaines de hb chez la drosophile avec des pourcentages de ressemblance respectifs de 81 %, 81 % et 70 %. Les deux domaines situés en position C-terminale ont 43 % de ressemblance avec les domaines situés au même endroit sur hb [13]. En amont de la séquence codant cette protéine, une autre séquence (un exon de lzf2) code 65 acides aminés correspondant à un domaine en doigt de zinc. La séquence NRE de lzf2 est située à 20 nucléotides du codon STOP donc dans la partie 3’UTR de la protéine comme sur hb chez la drosophile et a le même rôle dans la régulation de la protéine que chez la drosophile à savoir la fixation de la protéine Nanos qui inhibe l’expression de hb. Lzf1 code aussi des domaines en doigts de zinc mais est très peu exprimé dans l’embryon[13].
Lzf2 a une expression maternelle et zygotique mais son expression présente quelques différences par rapport à son homologue chez la drosophile. Lzf2 est exprimé au tout début de l’embryogénèse, au début des divisions cellulaires. Pendant la segmentation, lzf2 est exprimé dans l’ectoderme et le mésoderme le long de l’axe antéro-postérieur alors que chez la drosophile l’expression de hb ne se fait que dans la partie antérieure. La segmentation de la drosophile nécessite un gradient de HB, pas celle de la sangsue. Lzf2 et hb n’ont donc pas le même rôle pendant la segmentation. Cela suggère que hb a acquis sa fonction de gène gap chez les arthropodes ou chez les insectes après la divergence avec les annélides ce qui n’est pas incompatible avec l’idée que hb ait subi une cooptation au cours de la séparation entre arthropodes et annélides lui permettant d’acquérir cette nouvelle fonction. Lzf2 est également exprimé pendant l’organogénèse dans le système nerveux, l’intestin et des structures épidermiques dans chaque segment[13].
Lzf1 et lzf2 sont en réalité des gènes orthologues à Hunchback chez la drosophile, c’est-à-dire qu’ils sont homologues et dérivent d’un seul gène présent chez l’ancêtre commun des insectes et des annélides, cela est confirmé par des séquences similaires. Deux scénarios permettent d’expliquer l’orthologie entre lzf2 et hb :
- L’ancêtre commun aux annélides et aux arthropodes ne possédait pas de gène ayant une fonction de gène gap, cette fonction est apparue chez les arthropodes ou les insectes.
- L’ancêtre commun aux annélides et aux arthropodes possédait un gène ayant un rôle de gène gap, cette fonction aurait été perdue chez les annélides.
Le premier scénario est le plus probable car les sangsues ont un type de segmentation retrouvée chez tous les annélides et certains arthropodes donc elles représentent la forme ancestrale[13].
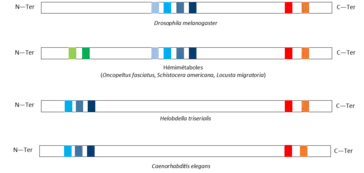
Lzf1 et lzf2 sont paralogues, ils proviennent d’une duplication du gène de l’ancêtre commun des annélides et des arthropodes survenue après la séparation de ces 2 groupes[13].
Chez Caenorhabditis elegans
Le gène homologue à Hunchbak de cette espèce de nématode est Hbl-1. Il code une protéine de 982 acides aminés possédant des domaines en doigt de zinc. Trois sont situés dans la partie N-terminale et sont similaires à 72 % à ceux de la drosophile, les deux situés dans la partie C-terminale ne présentent que 25 % de similitudes[14].
A l’inverse de la drosophile, ce gène n’est pas exprimé maternellement, il est uniquement transcrit dans l’embryon. Il n’intervient donc pas au début de embryogenèse contrairement à la drosophile mais est très important pour le développement de l’embryon puisque des mutants pour ce gène n’ont pas un développement complet. Hbl-1 est exprimé dans les cellules de l’hypoderme où il permet leur différenciation. Il est également exprimé dans les cellules qui donneront le pharynx et dans les neuroblastes. Hbl-1 participe aussi à la formation de la vulve car il intervient dans l’identité temporaire des cellules précurseurs de la vulve (CPV) [14]. Il est exprimé dans la larve à différents stades, hbl-1 régule le timing de développement de la larve[15].
Chez les vertébrés
Des orthologues au gène hunchback chez les vertébrés n’ont pas encore été trouvés mais les protéines de la famille Ikaros possèdent des domaines en doigt de zinc similaires à ceux de la protéine HB de la sauterelle [16]. Ces protéines participent à la régulation de gènes intervenant dans le complexe de remodelage de la chromatine dans les lymphocytes permettant la détermination et le contrôle de la prolifération de ces cellules[17].
Ikaros interagit avec l’orthologue de dMI-2 chez la souris [17]. Cette fonction a donc été conservée au cours de l’évolution. De plus, les séquences codant les domaines en doigts de zinc de la protéine Ikaros chez la souris et l’homme sont similaires et organisées en synténie, sur le chromosome 7 chez l’homme et 11 chez la souris [18]. Des orthologues à Ikaros ont été identifiés chez Raja eglanteria, un chondrichtyen, groupe basal, suggérant ainsi que ces gènes et leur fonction ont été conservés au cours de l’évolution des vertébrés[19].
Hunchback, un gène conservé au cours de l'évolution
La fonction du gène Hunchback est fortement conservée, malgré quelques différences, au cours de l’évolution chez les insectes. Son rôle est important pour la mise en place de l’axe antéro-postérieur. Son implication dans le système nerveux est aussi présente chez plusieurs organismes.
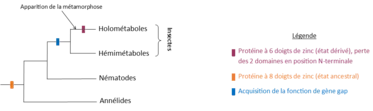
Les comparaisons d’orthologues à hb dans d’autres espèces animales ont montré que les séquences de ces gènes présentent de grandes similitudes. Les séquences présentant le plus haut degré de conservation étant celles codant les domaines en doigt de zinc de la protéine HB [20]. Hunchback ayant un rôle crucial au cours de l’embryogénèse et permettant la régulation d’autres gènes, les pressions de sélection sur les régions codant les sites de fixation de HB à l’ADN ont été très fortes au cours de l’évolution c’est pourquoi les séquences des gènes orthologues à hb présentent autant de similitudes. Plus généralement, les homéoboites sont des séquences très conservées au cours de l’évolution.
Le fait que les hémimétaboles aient une protéine avec 8 domaines en doigt de zinc similaires à certains retrouvés chez les annélides et les nématodes suggère que l’état ancestral était celui à 8 doigts de zinc et qui était donc l’état retrouvé chez l’ancêtre commun aux annélides, nématodes et arthropodes. Au cours de l’évolution il y a eu perte des domaines en position N-terminale pour passer à 6 domaines chez les insectes holométaboles. Les 2 domaines en position N-terminale doivent avoir un rôle au cours du développement des insectes hétérométaboles qui n’est plus nécessaire chez les holométaboles. De plus, le rôle de hb dans la formation de l’axe antéro-postérieur n’est pas présent chez les annélides et nématodes suggérant que ce rôle est apparu plus tard au cours de l’évolution des arthropodes ou des insectes. Enfin, l’expression de hb et sa fonction dans la serosa a été perdue au cours de l’évolution vers la drosophile puisque ce tissu extra embryonnaire n’est présent que dans les lignées d’insectes plus basales.
La séquence codant le site de fixation de dMI-2 à la protéine HB est très conservée puisqu’on retrouve une séquence similaire sur les protéines de la famille Ikaros chez les vertébrés. Cependant, aucun homologue à hb qui pourrait intervenir dans la métamérisation des vertébrés n’a encore été trouvé.
Voir aussi
Articles connexes
Notes et références
- (en) Tautz. D, « Regulation of the Drosophila segmentation gene Hunchback by two maternal mophogenetics centers », Nature (332), , p. 281-284
- (en) Lemand. R. & Nüsslein-Volhard. C, « Hunchback, a gene required for segmentation of an anterior and posterior region of the Drosophila embryo », Developmental Biology (119), , p. 402-417
- (en) Isshiki. T & al, « Drosophila neuroblasts sequentially express transcription factors wich specify the temporal identity of their neuronal progeny », Cell (106), , p. 511-521
- (en) Kambadur. R & al, « Regulation of POU genes by castor and hunchback establishes layered compartments in the Drosophila CNS », Genes & Development (12), , p. 246-260
- (en) Zhang. C & Bienz. M, « Segmental determination in Drosohila conferred by Hunchback (hb), a repressor of the homeotic gene Ultrabithorax (Ubx) », Proceedings ofthe National Academy of Sciences (89), , p. 7511-7515
- (en) Kehle. J & al, « dMI-2, a Hunchback-interacting protein that functions in Polycomb repression », Science (282), , p. 1897-1900
- (en) Hülskamp. M & al, « Differential regulation of target genes by different alleles of the segmentation gene Hunchback in Drosophila », Genetics (138), , p. 125-134
- (en) Garcia Solache. M. A & al, « A systemactic analysis of the gap gene system in the moth modge clogmia albipunctata », Developmental Biology (344), , p. 306-318
- (en) Janssens. H & al, « A quantitative atlas of Even-skipped and Hunchback expression in Clogmia albipunctata (Diptera : Psycholidae) blastoderm embryos », EvoDevo (5), , p. 1-13
- (en) Wolf.C & al, « Conserved and divergent expression aspects of the Drosophila segmentation gene Hunchback in the short germ band embryo of the flour beetle Tribolium », Development (121), , p. 4227-4236
- (en) Liu. P. Z & Kaufman. T. C, « Hunchback is required for suppression of abdominal identity, and for proper germband growth and segmentation in the intermediate germband insect Oncopeltus fasciatus », Development (131), , p. 1515-1527
- (en) Patel. N & al, « Grasshopper Hunchback expression reveals conserved and novel aspects of axis formation and segmentation », Development (128), , p. 3459-3472
- (en) Savage. R. M & Shankland. M, « Identification and characterization of a hunchback orthologue, Lzf2 and its expression during leech embryogenesis », Developmental Biology (175), , p. 205-217
- (en) Fay. S & al, « Caenorhabditis elegans homologue of Hunchback is required for late stages of development but not early embryonic patterning », Developmental Biology (205), , p. 240-253
- (en) Abrahante. J. E. & al, « The Caenorhabditis elegans Hunchback-like Gene lin-57/hbl-1 controls developmental time and is regulated by microRNAs », Developmental Cell (4), , p. 625-637
- (en) Georgopoulos. K, « Ikaros, anearly lymphoid-specific transcription factor and a putative mediator for T cell commitment », Science (258), , p. 808-812
- (en) Kim. J & al, « Ikaros DNA-Binding proteins direct formation of chromatin remodeling complexes in lymphocytes », Immunity (10), , p. 345-355
- (en) Molnar. A & al, « The Ikaros gene encodes a family of lymphocyte-restricted zinc finger DNA binding proteins, highlt conserved in human and mouse », Journal of Immunology (156), , p. 585-592
- (en) Haire. R & al, « Members of the Ikaros gene family are present in early representative vertebrates », Journal of Immunology (165), , p. 306-312
- (en) Sommer R. J & al, « Evolutionary conservation pattern of zinc-finger domains of Drosophila segmentation genes », Proceedings of the National Academy of Science (89), , p. 10782-10786