Cooptation (biologie)
La cooptation est un mécanisme se produisant, au cours de l'évolution, lorsque, sous des pressions sélectives, une nouvelle utilité pour un gène préexistant émerge à la suite de modifications[1]. Les gènes cooptés peuvent conserver leurs fonctions ancestrales en plus de leurs nouvelles fonctionnalités. Il y aura donc deux fonctionnalités au sein d'un organisme. Le concept de cooptation fait opposition à la synthèse de nouveaux gènes de novo au cours de l'évolution, c'est-à-dire la synthèse de gènes utilisant les constituants les plus simples des brins d'ADN.
La cooptation peut survenir autant sur un gène unique que sur une part d'un réseau génétique ou son ensemble où les mécanismes sont exactement les mêmes. Cependant, la relation entre un gène et une fonction développementale n'est pas admis comme un phénomène des plus communs. En revanche, la pléiotropie est un gène assumant plusieurs fonctions développementales qui elle, est une chose plus courante dans les processus développementaux. Elle forme ainsi un réseau génétique[2]. Toutefois, un gène ancestral avec une fonction unique peut être coopté au sein d'un réseau génétique régulateur du développement, et moduler la relation entre les gènes et les fonctions développementales vers une conjonction entre la pléiotropie et la polygénie. La cooptation au niveau des réseaux génétiques régulateurs du développement dans l'optique des mécanismes évolutifs est génératrice de diversité morphologique, elle sera donc plus amplement exemplifiée.
Histoire

Dans un article publié en 1977, Evolution and tinkering, François Jacob, inspiré par la lecture de La pensée sauvage de Claude Lévi-Strauss (1962), propose une métaphore décrivant les mécanismes évolutifs, en terme moléculaire. Il comparait les processus évolutifs au fonctionnement d'un bricoleur lors de sa démarche créatrice en opposition à un processus se rattachant à l'approche d'un ingénieur[2]. Contrairement aux processus évolutifs, l'ingénieur a dans une certaine mesure accès au futur, c'est-à-dire qu'il peut concevoir l'aspect final de son projet, et avoir à sa disposition les matériaux nécessaires propres à l'achèvement de son objectif. Les nouveautés procédant des processus évolutifs ne peuvent être reliés à un objectif quelconque. Elles procèdent d’événements reliés au hasard et sont contraintes par les limitations des matériaux préexistants. Chaque nouveauté enrichie de cette façon, les matériaux disponibles et les nouveautés engendrées seront stabilisées si leur utilité se révèle adaptée aux conditions qui font vigueur au moment de leur émergence[3].
Une des plus grandes découvertes en biologie valide l'intuition de François Jacob. Avec le séquençage du génome de plusieurs animaux modèles en biologie, les faits révèlent que la plupart des animaux partagent un groupe de gènes reliés au développement similaire conduisant à leur différente morphologie[4]. À plus forte raison, les gènes du développement dans les différents embranchements du règne animal furent cooptés. Les gènes en question seront homologues s'ils sont cooptés avant la divergence des lignées, et s'ils font suite à la divergence des lignées différentes du règne animal. Cela fait référence à l'homoplasie.
Modes
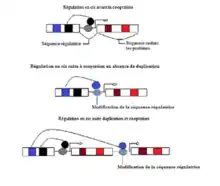
Deux modes généraux de cooptation des gènes ancestraux vers de nouvelles fonctions peuvent s'effectuer à la suite d'un processus de duplication des gènes ou non. Dans les deux cas, des modifications dans le patron d'expression spatio-temporelle peuvent s'effectuer. Une modification dans le patron d'expression spatial fait référence à l'activité d'un gène dans un nouveau groupe de cellules ou tissus. Un gène A est activé dans une nouvelle localité par l'expression d'un gène B toujours actif dans cette même localité. Une modification dans le patron d'expression temporelle fait référence à l'activité d'un gène à des moments précis durant l'ontogénie dans un groupe de cellules ou tissus. Un gène A est activé par l'expression différentielle dans le temps du gène B.
Absence de duplication des gènes
Dans le cas où il n'y a pas eu de duplications de gènes, la cooptation survient soit par des mutations des séquences codant les protéines donnant lieu à des nouveaux domaines protéiques et/ou des mutations des séquences régulatrices générant un nouveau patron d'expression spatio-temporelle du gène par des modifications de sa séquence régulatrice. De telles modifications peuvent être éventuellement causées par l'apparition de nouveaux amplificateurs[1], ou de nouveaux « silencer » à tissus spécifiques.
Par exemple, posons un gène A ne pouvant être activé par les protéines régulatrices de la transcription exprimé par un gène B dans un tissu donné. À la suite de la cooptation du gène A les modifications à sa séquence régulatrice peuvent lui permettre d'être activé dans une nouvelle localité ou à des temps différents au cours de l'ontogénie par les protéines régulatrices de la transcription du gène B. Sa fonction première, dans le cas où il y a absence de duplication, est généralement conservée et participera à la fonction globale de l'expression du gène A et B. Le gène B, dans cet exemple, pourrait être un gène régulateur en amont d'un réseau génétique.
À la suite de la duplication des gènes
Dans le cas où une duplication du gène se produit, les gènes paralogues vont diverger soit par la perte ou l'apparition d'amplificateurs à tissu spécifique différent dans leur séquence régulatrice respective et/ou par des mutations différentes de leurs séquences codant les protéines[1]. La combinaison de ces derniers conduira à la contingence de l'expression du gène dans des tissus spécifiques et en terme évolutif un gène ayant une nouvelle fonctionnalité exprimée ailleurs dans un organisme est générateur de nouveauté. L'expression ectopique de ces gènes sera permis par des facteurs de transcription exprimés exceptionnellement ou fréquemment dans des tissus où ils ne sont pas nécessaires donc non reliés à la fonction ancestrale de ces protéines[1] - [4].
Prépondérance des modes de cooptation
Les gènes cooptés ne procédant pas d'une duplication, ayant subi des mutations à leurs séquences codant les protéines ne sont que rarement conservés, puisque le gène ancestral subit de très grandes pressions sélectives quant au maintien de sa fonction. C'est-à-dire que la fréquence de présence de l'allèle au sein de l'espèce aura tendance à diminuer jusqu'à sa disparition dans les générations suivantes. Dans le cas où sa fonction est maintenue, le gène coopté sera en plus grande probabilité conservé comme dans l'exemple mentionné plus haut. La cooptation à la suite d'un processus de duplication permet à l'une des copies du gène, libre de toute contrainte fonctionnelle, de subir des modifications tandis que la fonction ancestrale du gène est prise en compte par la copie non altérée[1]. Les deux derniers cas de figure sont les modes de cooptation les plus probable de survenir et de mener à la conservation de la résultante de la cooptation.
Réseau génétique et cooptation des facteurs de transcriptions
Dans le génome des eucaryotes la duplication successive de quelques gènes, ayant eu occurrence au cours de l'évolution, a conduit à la formation de familles de gènes, à titre d'exemple au sein du génome des vertébrés il y a plusieurs copies d'un groupe de gènes ancestral relié au développement[2]. Faisant suite à la duplication, les gènes cooptés de chaque famille leur allouent des rôles différents, soit par des variations dans le patron spatio-temporel de leur expression et/ou dans la génération d'une nouvelle spécificité des produits des gènes. Formant ainsi un réseau génétique relié ensemble par des protéines régulatrices de la transcription suivant un mode de régulation en cis, dont il est proposé que la cooptation de modules de ces réseaux peut prendre part dans le développement de différents traits d'un organisme[5]. Il est toutefois probable, qu'au cours de l'évolution, des gènes ayant une fonction unique soient annexés (cooptés) à un réseau préexistant ajoutant un potentiel de fonctionnalité plus ample au réseau génétique régulateur du développement.
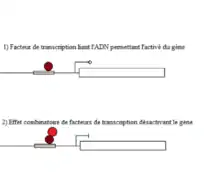
Les réseaux génétiques sont sous-tendus par le haut potentiel de recrutement (cooptation) des protéines régulatrices de la transcription. Ces protéines ont un nombre limité de façon dont elles peuvent lier l'ADN soit par leur homéodomaine, tandis que les domaines protéiques adjacents à l'homéodomaine sont libres de contraintes et peuvent subir des mutations. Le peu de variabilité dans les homéodomaines et les variations potentielles qui lui sont adjacentes permettant une différente fonctionnalité sous-tend leur haut potentiel de cooptation[5]. C'est la cooptation des protéines régulatrices concomitante à la cooptation des gènes plus particulièrement dû aux modifications de leurs séquences régulatrices qui crée en quelque sorte la connectivité fonctionnelle spécifique des réseaux génétiques de régulation.
Posons un réseau génétique ancestral spécifique au développement d'un tissu comprenant un gène A, B, C et D, où le gène A serait le gène en amont de ce réseau c'est-à-dire que son activation entame la cascade biochimique qui activera les autres. Par exemple, le facteur de transcription découlant de l'expression du gène A régule l'expression du gène B et ainsi de suite. Maintenant, posons que le même réseau soit coopté selon un des modes présentés antérieurement permettant l'expression de se réseau dans une nouvelle location. Chaque gène divergera de façon indépendante, à supposer que B et C soit un module du réseau ABCD et que les mutations dans la séquence régulatrice subite par ces derniers les rendent moins sensibles aux facteurs de transcription de A ou que l’interaction entre les facteurs de transcription déjà présents dans la nouvelle localité et ceux produit par A inhibent la capacité de liaisons du facteur de transcription du gène A sur le gène B. Cela entraînerait la génération de nouveautés par la présence de sous-caractères du premier tissu dans le second. Cette différence entre les caractères des tissus est générée par la disparité entre l'expression de l'ensemble du réseau ou seulement d'une partie du réseau.
Exemples
Adénine et cadhérine
Une découverte récente, à la suite du séquençage de plusieurs protistes, révèle que plusieurs unicellulaires expriment des protéines qui étaient admises comme des protéines propres aux organismes multicellulaires. Les protéines comme l'intégrine et la cadhérine jouent un rôle dans l'adhésion entre cellules et dans la signalisation intercellulaire au sein des organismes pluricellulaires[6]. La fonction ancestrale de ces protéines chez les protistes jouerait un rôle dans l'interaction avec l’environnement extracellulaire. Soit un rôle dans la prédation des proies comme des bactéries ou dans interaction avec l'environnement dictant les variations dans les mécanismes physiologiques, tel que la croissance de l'organisme en question. Cette découverte met en lumière le rôle clé de la cooptation au sein des mécanismes évolutifs, puisque la cooptation pourrait être la pierre angulaire de l'origine des organismes multicellulaires[6].
Cet exemple est typique du partage de la fonction d'un gène au sein d'un organisme. La fonction ancestrale du gène est conservée et annexée à un réseau génétique du développement. Lors de l'ontogénie de l'organisme, des gènes exprimés entraînent par exemple la prolifération cellulaire, la migration cellulaire et en concert avec ces gènes, les gènes exprimant l'intégrine et la cadhérine permet leur adhésion et leur communication par des voies biochimiques, donnant ainsi une unité structurelle à l'ensemble des cellules.
Réseau génétique chez les diptères
.jpg.webp)
Le gène eyeless joue un rôle primordial dans la régulation, au sein d'un réseau génétique, de la formation des yeux au cours du développement des diptères. Ceci fut démontré par l'expression ectopique de eyeless, de façon artificielle, chez les drosophiles causant l'apparition d’œil dans des tissus différents soit les ailes, les antennes et les pattes[7].
La découverte chez un Ceratopogonidae[8], un diptère disparu, d'une unité structurelle des yeux, les ommatidies sur leur aile entraîna la proposition que certains modules du réseau génétique, comprenant eyeless, furent cooptés et exprimés de façon ectopique dans les ailes du diptère. La raison pour laquelle la cooptation des modules d'un réseau génétique fut proposée est le fait que la structure présente sur l'aile du diptère disparu n'est pas un œil complet, c'est-à-dire que seulement certains caractères morphologiques y sont représentés donc la totalité du réseau génétique n'est pas dans ce contexte exprimé. Il est proposé que eyeless serait un gène régulateur en amont du réseau génétique et pourrait activé indépendamment les modules du réseau génétique en dépit du fait que chacun des modules du réseau auraient un seuil d'activation différent, dû à leur cooptation, par l'expression de eyeless[5].
Puisque des gènes homologues à eyeless se retrouvent chez plusieurs groupes des métazoaires[7]. Il est aussi proposé que la cooptation des gènes responsables des pigments rouges, indispensables à la vision dans les yeux des insectes, serait responsable de la pigmentation rouge retrouvée sur les ailes de certains papillons[5].
Voir aussi
Articles connexes
Liens externes
Notes et références
Références
- (en) True, John R. et Carroll, Sean B. Gene, Co-option in physiological and morphological evolution. Annual Review of Cell and Developmental Biology, 2002, vol. 18, no 1, p. 53-80.
- (en) Duboule, Denis et Wilkins, Adam S. The evolution ofbricolage. Trends in Genetics, 1998, vol. 14, no. 2, p. 54-59.
- (en) Jacob, François. Evolution and tinkering. 1977.
- Rebeiz, Mark ; Jikomes, Nick ; Kassner, Victoria A., et al. Evolutionary origin of a novel gene expression pattern through co-option of the latent activities of existing regulatory sequences. Proceedings of the National Academy of Sciences, 2011, vol. 108, no. 25, p. 10 036-10 043.
- (en) Monteiro, Antónia. Gene regulatory networks reused to build novel traits. Bioessays, 2012, vol. 34, no 3, p. 181-186.
- (en) Sebé-Pedros, Arnau et Ruiz-Truillo, Iñaki. Integrin-mediated adhesion complex : Cooption of signaling systems at the dawn of Metazoa. Communicative & Integrative Biology, 2010, vol. 3, no. 5, p. 475.
- (en) Halder, Georg ; Callaerts, Patrick, et GEHRING, Walter J. Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila. Science, 1995, vol. 267, no. 5 205, p. 1788-1792.
- (en) Dinwiddie, April et Rachootin, Stan. Patterning of a compound eye on an extinct dipteran wing. Biology letters, 2010, p. rsbl20100809.