Ester de nitrate
Un ester de nitrate est un groupe fonctionnel, généralement organique. Le terme est relativement ambigu, et on trouve des appellations concurrentes qui, bien que ne recouvrant pas exactement la même réalité dans le langage courant sont utilisés comme quasi synonymes.
- Dans sa définition large, un ester est le produit de condensation entre un acide quelconque (minéral ou organique) et un alcool. Un ester de nitrate est donc le produit de condensation entre l'acide nitrique, et un composé organique comportant une fonction alcool (-OH). Sa formule générale est RONO2, où R est un groupe organique. On parle aussi volontiers d'« organonitrate ».
- Un autre terme courant est l'appellation « nitrate d'alkyle », qui désigne au sens strict le produit de condensation entre l'acide nitrique est un alcanol (R-OH). Dans ce dernier cas, la formule générale reste RONO2, mais cette fois R est un groupe alkyle pur, pas un groupe organique général (c'est-à-dire un dérivé d'alkyle pouvant porter d'autres fonctions). Cette famille contiendrait donc en théorie uniquement les nitrate de méthyle, nitrate d'éthyle, nitrate de pentyle, etc. Toutefois, dans le langage courant, on regroupe régulièrement les alkyles et leur dérivés sous la simple appellation d'« alkyle », et « nitrate d'alkyle » devient donc un synonyme de la définition précédente.
Cet article traite donc des composés organiques de formule générale RONO2 où R est un groupe organique quelconque.
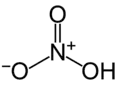 Acide nitrique, précurseur des esters de nitrate.
Acide nitrique, précurseur des esters de nitrate.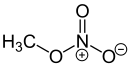 Nitrate de méthyle, le plus simple des esters de nitrate.
Nitrate de méthyle, le plus simple des esters de nitrate.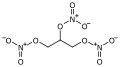 Nitroglycérine, un des plus connus esters de nitrate.
Nitroglycérine, un des plus connus esters de nitrate.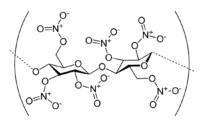 Nitrocellulose, polymère organique contenant de nombreux groupes ester de nitrate.
Nitrocellulose, polymère organique contenant de nombreux groupes ester de nitrate.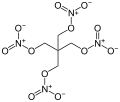 Tétranitrate de pentaérythritol, un puissant explosif contenant quatre groupes ester de nitrate.
Tétranitrate de pentaérythritol, un puissant explosif contenant quatre groupes ester de nitrate.
Les esters de nitrate ne doivent pas être confondus avec un groupe proche, les composés nitro (RNO2) qui comportent un oxygène de moins et où le groupe organique est directement relié à l'azote central. Cette confusion est amplifiée par le fait que de nombreux nitrates d'alkyle ont un nom courant qui commence par le préfixe nitro- ; c'est par exemple les cas de la nitroglycérine et du nitrocellulose qui sont bien des nitrates d'alkyle, respectivement le trinitrate de glycérol et le nitrate de cellulose, et non pas des composés nitro.
Synthèse
Les esters de nitrate sont typiquement préparés par condensation (« estérifcation ») entre l'acide nitrique et un alcool[1]. Cette réaction est similaire à la réaction d'estérification, qui est la réaction de condensation entre un acide carboxylique et un alcool, et comme elle, on la catalyse souvent par la présence d'un acide. Par exemple, le plus simple des esters de nitrate, le nitrate de méthyle est formé par réaction entre le méthanol et l'acide nitrique, en présence d'acide sulfurique[2] :
- CH3OH + HNO3 → CH3ONO2 + H2O
On appelle parfois cette réaction « nitroxylation ».
Propriétés explosives
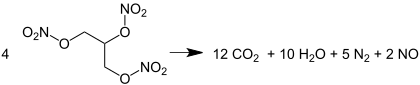
La décomposition thermique des esters de nitrate produit principalement du diazote (N2) et du dioxyde de carbone. L'énergie chimique considérable de la détonation vient de la forte triple liaison de la molécule de diazote. Cette stœchiométrie est illustrée par l'équation de la détonation de la nitroglycérine :
Un exemple illustratif de la forte sensibilité de certains orgnaonitrates est le cas de Si(CH2ONO2)4[3] - [4]. Un seul cristal de ce composé explose au contact d'une spatule en Téflon ce qui rend en fait sa caractérisation complète impossible. Un autre contributeur à la décomposition exothermique est la capacité du silicium dans le cristal de se coordonner avec deux des oxygènes des groupes nitrito en plus de sa coordination habituelle avec les quatre atomes de carbone. Cette coordination additionnelle favoriserait la formation de dioxyde de silicium (un des produits de la décomposition).
Usage médical
Les esters de nitrate tels que le dinitrate d'isosorbide (Isordil) et le mononitrate d'isosorbide (Imdur, Ismo, Monoket) sont convertis dans le corps en monoxyde d'azote, un puissant vasodilatateur naturel. En médecine, ces esters sont notamment utilisés dans le traitement de l'angine de poitrine.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Nitrate ester » (voir la liste des auteurs).
- Snyder, H. R.; Handrick, R. G.; Brooks, L. A., Imidazole, Org. Synth., coll. « vol. 3 », , p. 471.
- Alvin P. Black and Frank H. Babers, Methyl nitrate, Org. Synth., coll. « vol. 2 », p. 412.
- Thomas M. Klapötke, Burkhard Krumm, Rainer Ilg, Dennis Troegel et Reinhold Tacke, « The Sila-Explosives Si(CH2N3)4 and Si(CH2ONO2)4: Silicon Analogues of the Common Explosives Pentaerythrityl Tetraazide, C(CH2N3)4, and Pentaerythritol Tetranitrate, C(CH2ONO2)4 », J. Am. Chem. Soc., (DOI 10.1021/ja071299p).
- Stephen K. Ritter, « Sila-Explosives Offer A Better Bang », Chemical & Engineering News, (lire en ligne).