Nitrate de méthyle
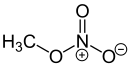
Le nitrate de méthyle est un composé organique, l'ester de méthyle de l'acide nitrique de formule CH3NO3. Il se présente sous la forme d'un liquide hautement volatil et explosif. Du fait de sa trop forte sensibilité, il n'a aucune application pratique en tant qu'explosif.
| Nitrate de méthyle | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | Nitrate de méthyle |
| Synonymes |
ester de méthyle de l'acide nitrique |
| No CAS | |
| No ECHA | 100.009.039 |
| PubChem | 11724 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, odeur forte |
| Propriétés chimiques | |
| Formule | CH3NO3 |
| Masse molaire[1] | 77,039 4 ± 0,002 1 g/mol C 15,59 %, H 3,93 %, N 18,18 %, O 62,3 %, |
| Propriétés physiques | |
| T° fusion | −82,3 °C[2] |
| T° ébullition | 64,6 °C (explosion)[2] |
| Masse volumique | 1,21 g·cm-3[3] |
| Propriétés optiques | |
| Indice de réfraction | 1,374 8[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Le nitrate de méthyle est un explosif sensible. Lorsqu'il est enflammé, il brûle avec une flamme gris-bleu extrêmement vive. Il possède cependant une brisance relativement basse en comparaison d'autres explosifs, y compris les autres esters de nitrate. Sa sensibilité à l'initiation par détonation est l'une des plus grandes connues, même un détonateur de niveau un (plus faible puissance existante) provoquant la détonation totale de l'explosif.
Malgré ses propriétés explosives supérieures, le nitrate de méthyle n'a pas d'application en tant qu'explosif, du fait de sa sensibilité, mais aussi surtout du fait de sa haute volatilité, ce qui l'empêche d'être stocké et manipulé en toute sécurité. Durant la Seconde Guerre mondiale, l'Allemagne l'utilisait comme carburant pour fusée dans un mélange avec 25 % de méthanol, connus sous le nom de « myrol ». Le mélange s'évaporant à taux constant, sa composition ne change pas au cours du temps.
Synthèse
Le nitrate de méthyle peut être produit par estérification (condensation) de l'acide nitrique par le méthanol[4] :
- CH3OH + HNO3 → CH3NO3 + H2O
Il peut être produit en laboratoire ou à échelle industrielle par distillation d'un mélange méthanol/acide nitrique, ou par réaction du méthanol par un mélange d'acide sulfurique et d'acide nitrique. La première méthode n'est pas celle la plus employée du fait du risque important d'explosion des vapeurs de nitrate de méthyle. La seconde est à peu près identique à celle de préparation de la nitroglycérine. Cependant, la fabrication a généralement lieu à une température légèrement plus haute et le mélange est remué mécaniquement et non pas avec de l'air comprimé.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Methyl nitrate » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- CRC Handbook of Chemistry and Physics, 90e éd., chap. 3 (« Physical Constants of Organic Compounds »), p. 360
- (de) « Salpetersäureester », sur Römpp Online, Georg Thieme Verlag (consulté le )
- Black, A. P.; Babers, F. H., Methyl nitrate, Org. Synth. 19, coll. « vol. 2 », , 64 p., p. 412
