Dopamine bêta-hydroxylase
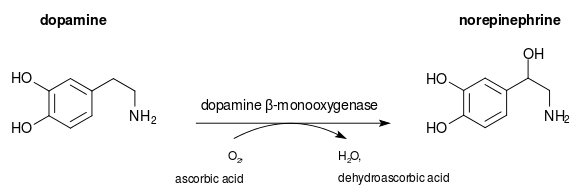
La dopamine bêta-hydroxylase (DBH), aussi connu comme la dopamine bêta-monooxygénase, est une enzyme (EC ) qui chez les humains est codée par le DBHgène. La Dopamine bêta-hydroxylase catalyse la réaction chimique:
| Dopamine β-hydroxylase | ||
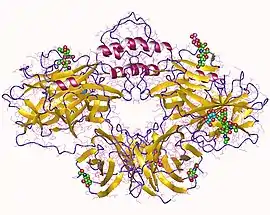 Homodimère de dopamine β-hydroxylase humaine (PDB 4ZEL) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Dopamine β-hydroxylase | |
| Symbole | DBH | |
| N° EC | 1.14.17.1 | |
| Homo sapiens | ||
| Locus | 9q34.2 | |
| Masse moléculaire | 69 065 Da[1] | |
| Nombre de résidus | 617 acides aminés[1] | |
| Entrez | 1621 | |
| HUGO | 2689 | |
| OMIM | 609312 | |
| UniProt | P09172 | |
| RefSeq (ARNm) | NM_000787.3 | |
| RefSeq (protéine) | NP_000778.3 | |
| Ensembl | ENSG00000123454 | |
| PDB | 4ZEL | |
|
GENATLAS • GeneTests • GoPubmed • HCOP • H-InvDB • Treefam • Vega | ||
| Liens accessibles depuis GeneCards et HUGO. | ||
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Les trois substrats de cette enzyme sont 3,4-dihydroxyphenethylamine, l'ascorbate, et O2, tandis que ses trois produits sont la noradrénaline, dehydroascorbate, et H2O.
La DBH est une protéines de poids 290 kDa contenant du cuivre oxygénase composé de quatre sous-unités identiques, et de son activité nécessite l'ascorbate comme un cofacteur[2].
C'est la seule enzyme impliquée dans la synthèse de petites molécules de neurotransmetteurs qui est liée à la membrane, faisant de la noradrénaline, le seul connu de l'émetteur synthétisés à l'intérieur de vésicules. Elle est exprimée en noradrénergique terminaisons nerveuses du système nerveux central et périphérique, ainsi que dans les cellules chromaffines de la médullosurrénale.
Sur la base des observations de ce qui se passe quand il n'y a pas de substrat, ou d'oxygène, les étapes suivantes semblent constituer la réaction d'hydroxylation[3] - [4].
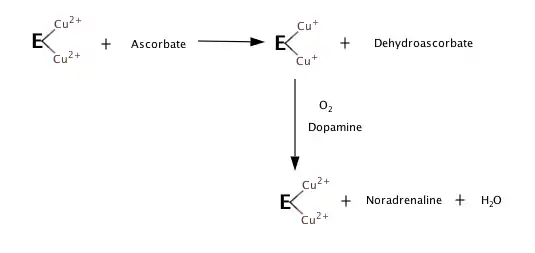
Bien que les détails de DBH mécanisme sont encore à confirmer, le DHP est l'homologue d'une autre enzyme, peptidylglycine α-hydroxylation monooxygénase (PHM). Parce que le DBH et PHM partagent les mêmes structures, il est possible de modèle DHP mécanisme basé sur ce qui est connu au sujet de PHM mécanisme[5].
Spécificité de substrat
La Dopamine bêta-hydroxylase catalyse l'hydroxylation non seulement de la dopamine, mais aussi d'autres phényléthylamine dérivés lorsqu'ils sont disponibles. L'exigence minimale semble être un anneau de benzène avec un à deux carbones de la chaîne latérale qui se termine dans un groupe amino.
La signification clinique
DBH contribue principalement à l'action des catécholamines et de la trace de l'amine de la biosynthèse. Il intervient aussi dans le métabolisme des xénobiotiques liés à ces substances, par exemple, l'homme DBH enzyme catalyse la bêta-hydroxylation de l'amphétamine et de la para-hydroxyamphétamine, la production de la noradrénaline et de la para-hydroxynorephedrine respectivement[6] - [7] - [8].
DHP a été impliqué comme facteur de corrélation dans des conditions associées à la prise de décisions et de dépendance de la drogue, par exemple, l'alcoolisme[9] et le tabagisme[10], déficit de l'attention avec hyperactivité[11], la schizophrénie[12], et la maladie d'Alzheimer[13]. Inadéquate DHP est appelé dopamine bêta-hydroxylase carence.
Structure
Parce qu'il est difficile d'obtenir une stabilité de cristal de la dopamine bêta-hydroxylase, sa structure cristalline est pas encore résolu. Cependant, une homologie modèle basé sur la séquence primaire et à la comparaison des PHM est disponible.
Références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) R. A. Rush et L. B. Geffen, « Dopamine beta-hydroxylase in health and disease », Critical Reviews in Clinical Laboratory Sciences, vol. 12, no 3, , p. 241–77 (PMID 6998654, DOI 10.3109/10408368009108731)
- (en) S. Kaufman, « The Mechanism of Action of Dopamine beta-Hydroxylase. », Advances in Chemistry, vol. 77, chapter 73, , p. 172–176 (DOI 10.1021/ba-1968-0077.ch073)
- « An electron paramagnetic resonance study of 3,4-dihydroxyphenylethylamine beta-hydroxylase », The Journal of Biological Chemistry, vol. 241, no 10, , p. 2256–9 (PMID 4287853)
- « New insights into copper monooxygenases and peptide amidation: structure, mechanism and function », Cellular and Molecular Life Sciences, vol. 57, nos 8-9, , p. 1236–59 (PMID 11028916, DOI 10.1007/pl00000763)
- (en) Glennon RA (section : Phenylisopropylamine stimulants: amphetamine-related agents), Foye's principles of medicinal chemistry, Philadelphia, USA, Wolters Kluwer Health/Lippincott Williams & Wilkins, , 1520 p. (ISBN 978-1-60913-345-0, lire en ligne)
« The phase 1 metabolism of amphetamine analogs is catalyzed by two systems: cytochrome P450 and flavin monooxygenase. ... Amphetamine can also undergo aromatic hydroxylation to p-hydroxyamphetamine. ... Subsequent oxidation at the benzylic position by DA β-hydroxylase affords p-hydroxynorephedrine. Alternatively, direct oxidation of amphetamine by DA β-hydroxylase can afford norephedrine. »
- Taylor KB, « Dopamine-beta-hydroxylase. Stereochemical course of the reaction », J. Biol. Chem., vol. 249, no 2, , p. 454–458 (PMID 4809526, lire en ligne, consulté le ) :
« Dopamine-β-hydroxylase catalyzed the removal of the pro-R hydrogen atom and the production of 1-norephedrine, (2S,1R)-2-amino-1-hydroxyl-1-phenylpropane, from d-amphetamine. »
- « Human serum dopamine-β-hydroxylase. Relationship to hypertension and sympathetic activity », Circ. Res., vol. 32, no 5, , p. 594–599 (PMID 4713201, DOI 10.1161/01.RES.32.5.594) :
« Subjects with exceptionally low levels of serum dopamine-β-hydroxylase activity showed normal cardiovascular function and normal β-hydroxylation of an administered synthetic substrate, hydroxyamphetamine. »
- « Functional polymorphism of the dopamine β-hydroxylase gene is associated with increased risk of disulfiram-induced adverse effects in alcohol-dependent patients », Journal of Clinical Psychopharmacology, vol. 32, no 4, , p. 578–80 (PMID 22760354, DOI 10.1097/jcp.0b013e31825ddbe6)
- « Association between dopamine beta hydroxylase rs5320 polymorphism and smoking behaviour in elderly Japanese », Journal of Human Genetics, vol. 57, no 6, , p. 385–90 (PMID 22513716, DOI 10.1038/jhg.2012.40)
- « Analysis of polymorphisms in the dopamine beta hydroxylase gene: association with attention deficit hyperactivity disorder in Indian children », Indian Pediatrics, vol. 42, no 2, , p. 123–9 (PMID 15767706)
- « Linkage analysis of plasma dopamine β-hydroxylase activity in families of patients with schizophrenia », Human Genetics, vol. 130, no 5, , p. 635–43 (PMID 21509519, DOI 10.1007/s00439-011-0989-6)
- « The dopamine β-hydroxylase -1021C/T polymorphism is associated with the risk of Alzheimer's disease in the Epistasis Project », BMC Medical Genetics, vol. 11, no 161, , p. 162 (PMID 21070631, DOI 10.1186/1471-2350-11-162)
- « Structural insight of dopamine β-hydroxylase, a drug target for complex traits, and functional significance of exonic single nucleotide polymorphisms », PLOS ONE, vol. 6, no 10, , e26509 (PMID 22028891, PMCID 3197665, DOI 10.1371/journal.pone.0026509)