Dendrochimie
La dendrochimie est une méthode de biosurveillance de l'environnement basée sur le fait que les anneaux de croissance des arbres ont lors de leur formation enregistré une partie de la pollution de leur environnement. Certains de ces polluants ne sont pas dégradables (métaux lourds et métalloïdes) ou ont une longue durée de vie ; ils peuvent être absorbés par l'arbre sous forme gazeuse, particulaire et/ou sous forme dissoute (c'est-à-dire ionique) ; Le bois vivant (puis mort) absorbe et stocke ainsi une partie des métaux et minéraux que l’arbre a captés dans l’eau, l’air et/ou le sol qui l'alimentent sa vie durant, via ses racines, ses feuilles, et moindrement via l’écorce et le suber. Ce stock interne se forme en plus ou moins grandes quantités selon l’essence et l’âge de l’arbre, et selon le contexte environnemental.
En zone froide à tempérée, durant toute la période de croissance de l’arbre (plusieurs siècles parfois), chaque année, un nouveau cerne est produit, qui absorbe et conserve une partie des minéraux et polluants captés par l’arbre dans l’année (et les mois précédents via l’écorce).
Sauf chez quelques espèces, dans le bois d’un arbre vivant et sain ou dans le bois sec d’une poutre ou d’une planche ancienne, ces produits migrent très peu d’un cerne à l’autre, ou des cernes déjà formé vers le suber ou l’écorce, ce qui fait des cernes une archive environnementale potentiellement exploitable des années à millénaires après qu’ils se soient constitués[2] - [3] - [4].




.jpg.webp)
.jpg.webp)
.jpg.webp)


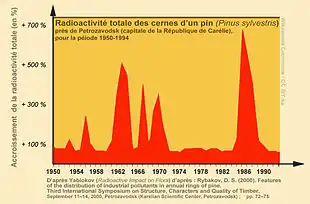

Après la Seconde Guerre mondiale et la bombe atomique, de nombreux essais nucléaires atmosphériques ont (dans les années 1950) libéré une grande quantité de divers radionucléides et radio-isotopes (dont carbone 14) dans l'air ; assez pour doubler le taux normal de C-14 de l'atmosphère, et par suite pour le faire augmenter dans la biomasse et nécromasse (partie gauche du graphique). Le pic situé à droite correspond au relargage dans l'atmosphère de C-14 par la catastrophe de Tchernobyl

Enjeux environnementaux et de santé publique
- la dendrochimie, permet d’évaluer certaines contaminations de l’environnement (eau, air, sol) et leur évolution sur des pas de temps se comptant en décennies à millénaires, ce qui en fait un outil pour l’histoire et l’histoire environnementale ;
- La dendrochronologie peut renseigner sur certaines pollutions passées, métalliques et radioactives notamment, au profit d’études épidémiologiques ;
- La dendrochimie peut être utile à la gestion du risque. Par exemple : l’écorce et le suber (partie périphérie du tronc située juste sous l’écorce) ne constituent qu’une petite partie d’un tronc adulte, mais c’est la partie souvent la plus « contaminée » par les métaux. Or cette partie de l’arbre n’est pas utilisée dans le bois d’œuvre, ce qui en fait un déchet pour cette industrie. Elle peut être utilisée pour produire du « mulch » (qui, si l’arbre venait d’une zone polluée libérera des polluants en se décomposant) ou parfois en bois-énergie (de mauvaise qualité car laissant beaucoup de cendre, par ailleurs souvent très contaminées par les métaux).
Connaitre et mieux gérer les risques écologiques et les risques sanitaires posés par l’utilisation sans précaution des écorces, du suber, ou de bois pollués est donc un enjeu, tout particulièrement pour les vieux arbres urbains, ou ayant poussé près de routes ou de zones industrielles ou exposées aux pollutions de guerre. - La dendrochimie peut éclairer certains problèmes écoépidémiologiques : quand l’arbre pollué vieillit et qu’il est attaqué par des insectes xylophages ou des insectes et autres organismes saproxylophages), selon la profondeur de vie des larves d'insectes, champignons et bactéries dans le bois, ces organismes pourront bioaccumuler des métaux toxiques (ex : arsenic dans les terrains de golf qui ont utilisé ce produit comme pesticide durant des décennies). Les oiseaux (pics) qui se nourrissent sur de tels arbres sénescents, empoisonnent leurs progénitures en les nourrissant ; il se retrouvent en situation de piège écologique[5].
Ce bois devrait être utilisé avec précaution et brûlé dans des installations munies de filtres adéquats, c’est-à-dire capables de capter les métaux et métalloïdes de vapeurs et fumées de combustion. Leur cendre sera également contaminée.
Absorption et stockage de polluants par le bois
Écorces
L’écorce des arbres adsorbe et accumule divers contaminants (issus de déposition humide et sèche)[6].
Cette propriété a été utilisée avec succès par de nombreuses études de contamination, y compris en milieux arides (ex : en Jordanie où des écorces de cyprès étaient disponibles (Cupressus sempervirens)[7].
L’écorce reflète souvent très bien la contamination locale de l’environnement par un polluant (ainsi Heichel et Hankin, 1972) ont montré que la composition isotopique du plomb microparticulaire intégrée dans les écorces était identique à celle du plomb additif de l’essence [8]. Selon Barnes et al. (1976), les métaux sont plus concentrés dans les couches superficielles de l'extérieur de l'écorce, par rapport aux couches internes de l’écorce. Et les teneurs peuvent aussi varier selon la hauteur le long de la tige ou du tronc[9].
Selon le type d’écorce (qui varie beaucoup selon l’âge et l’espèce) le taux de particules retrouvé sur l’écorce varie considérablement (par exemple d’un facteur de 1 à 10 rien que sur 7 espèces testées dans la cuvette grenobloise en France) ; Dans ce contexte, le peuplier noir (Populus nigra) en contenait le plus et le Paulownia (Paulownia imperialis) le moins notait Mickaël Catinon en 2010[10].
Suber
Le suber est la partie vivante la plus externe de l’écorce et de l’arbre.
C’est aussi le tissu généralement le plus contaminé, notamment car contenant (pour plusieurs décennies) les métaux absorbés par les racines et feuilles … en plus d’une partie de ceux qui se sont déposés sur l’écorce (plus ou moins naturellement acide selon l’espèce ou acidifiée par la pollution de l’air) [10].
Une écorce naturellement acide (ou acidifiée par les SOx et/ou les NOx) rend les métaux qu’elle rencontre plus biodisponibles, y compris pour le suber. Une expérimentation consistant à exposer une épinette à une fumigation de soufre (sous forme de SO2, un polluant courant de l’air dans les zones de combustion d’hydrocarbures fossiles, fuels lourds et carburants diesels notamment) a montré que le soufre s'accumule facilement dans l'écorce et peut alors fortement l’acidifier (en y produisant de l'acide sulfurique (H2SO4), dont la plus grande partie va réagir avec le calcium en formant du gypse (CaSO4)[11]. Kreiner & Härtel ont en 1986 conclu de cette expérience que la conductance et la teneur en sulfate des extraits d’écorce représentent et mémorisent une intégration de soufre anthropique couvrant une période « considérable »[11].
La thèse de Mickael Catinon (2010) a montré que sur les branches et écorces, les dépôts atmosphériques secs et humides influencent directement la teneur en contaminants du suber sous-jacent, mais avec une chronologie décalée, car le dépôt de surface est en réalité un « écosystème construit sur un biotope alimenté conjointement par l'atmosphère et par l'arbre lui-même », comportant « une phase vivante reviviscente et pour partie photosynthétique » ; il et en outre périodiquement lessivé et déplacé par la pluie et le ruissellement d’eaux météoritiques. Le suber sous-jacent va néanmoins absorber et stocker, et donc « mémoriser » une partie de ce dépôt.
Bois
Si les métaux toxiques semblent rapidement fixés dans le bois et ces cernes (jusqu’à ce que le bois soit décomposé), ce n’est pas le cas des cations de micro nutriments vitaux comme : Ca, Mg, Mn et K qui sont retrouvés dans l’écorce et les cernes, mais en y étant bien moins « passivement » enregistrés.
Ils semblent pouvoir recirculer, par exemple lors de la maturation de l’aubier en bois de cœur, et ils interfèrent beaucoup plus avec la vie de l’arbre (météo, blessures, maladies, etc.). L’interprétation dendrochimique de leurs variations dans le bois doit donc rester très prudente[12].
Histoire scientifique
Ce moyen de remonter le passé s’est principalement développé dans les années 1970 où il a notamment montré que l’essence plombée laissait des traces annuelles dans le bois. Il a été encouragé par le fait que des arbres sont présents dans une large partie du monde, y compris en ville, dans des cours d’école ou dans les jardins. Leur écorce, le suber ou leurs cernes peuvent enregistrer les informations sur le passé de l’arbre et de son environnement, et un même arbre peut être utilisé à plusieurs reprises dans sa vie. La méthode semble idéale pour retracer des polluants non dégradables comme les métaux ou métalloïdes.
Le cas particulier du mercure
Comme il est hautement toxique, il est intéressant de pouvoir retracer les pollutions par ce métal. De plus le bois pollué par du mercure ne devrait pas être brûlé ni chauffé, car inhaler de la vapeur de mercure est bien plus toxiques qu’ingérer du mercure liquide.
Comme le mercure (Hg) est le seul métal liquide et volatil à température ambiante sur terre, on pouvait craindre que les cernes des arbres ne puissent pas l’accumuler ou mal le conserver ; On sait néanmoins depuis les années 1990 que ce métal très toxique peut se déposer et s’accumuler dans certaines zones boisées[13], et que là, le mercure est absorbé par les arbres[14] - [15] - [16].
On a montré en 2014 qu’il peut être recherché et retrouvé dans les cernes de pins où il est conservé[17], ce travail a permis de confirmer que le taux de mercure diminue en Amérique du nord long d'un gradient allant de la côte à l'intérieur (avec 5,7 ng/g sur la côte californienne, descendant à 1,2 ng/g à l'intérieur des terres au Nevada). Ce travail a aussi confirmé que les cernes du bois enregistrent aussi les effets de sources locales de mercure et qu’une augmentation des concentrations mondiales au fil du temps.
Une étude (2010) faite sur des zones contaminées et de sites de référence (non contaminés) autour de Kingston (Ontario)) a recherché le mercure total (HgT) dans le bois d’érable (Acer spp.), de chêne (Quercus spp.), de peupliers (Populus spp.)et de saules (Salix spp.)[18].
Les taux de HgT dans les écorces et le bois étaient fortement corrélées, contrairement aux concentrations dans le sol et le bois. Les espèces rivulaires (des berges et ripisylves) étudiées (saules et peupliers dans ce cas) présentaient les teneurs de mercure dans l'écorce et dans le bois les plus élevées (jusqu’à 18 ng/g, significativement plus élevées que pour les arbres de l'intérieur des terres (chêne et érable) qui ne dépassaient pas respectivement 7 et 1,2 ng/g de mercure pour l'écorce et le bois[18]. L’étude a estimé que les troncs d'arbres ne sont pas des biomoniteurs temporels fiable pour le HgT, mais que des essences tels que les peupliers et saules « sont prometteuses en tant qu'indicateurs spatiaux de la contamination locale à long terme par le mercure »[18].
D’autres études ont montré une corrélation de teneurs en Hg des cernes et des lichens vivant à proximité[19]. Elles ont permis avec des peupliers de reconstituer la variation temporelle de la contamination d’un site par le mercure « aquatique »[20] ou ont prouvé que la pollution mercurielle de mines ou de fonderies est « mémorisée » par les arbres[21].
La Recherche doit encore préciser la variation de la sensibilité des échantillons de cernes d’arbres en fonction de l’espèce et de l’âge, en tant que données indirectes sur les concentrations de Hg dans l’atmosphère[17]. Selon Whright & al ; (2014) les cernes des arbres sont des enregistreurs passifs de Hg atmosphérique pour de longues périodes (plusieurs siècles, voire plusieurs millénaires avec alors une précision d’environ 5 ans pour les datations rétrospectives [17]).
Conditions de faisabilité
En raison de certains facteurs limitants, utiliser la dendrochimie nécessite cependant plusieurs conditions :
- la disponibilité en arbre assez âgés pour avoir enregistré les évènements recherchés ;
- Le choix de l’essence doit être pertinent (il faut une essence à faible contamination radiale inter-cernes, frêne par exemple[22]) et capable de bioaccumuler le polluant (recherché ou suspecté, si l’étude vise un polluant particulier) ;
- Le polluant recherché doit ne pas pouvoir se dégrader dans le bois (ou son produit de dégradation doit être stable et facile à identifier) ;
- le métal ou polluant recherché doit être biodisponible (ainsi un sol très calcaire peut contenir une quantité anormalement élevée de plomb, et ne pas ou peu le libérer vers les arbres) ; on en retrouver alors peu dans le bois, sauf si un processus d’acidification est à l’œuvre là où l’arbre pousse ou à proximité ;
- il est utile de disposer d’« arbres témoins » (non pollués, de même âge et ayant grandi dans un environnement par ailleurs comparable, prospecté à la même profondeur par les racines) pour bien distinguer les effets de la pollution d’effets liés à des aléas climatiques ou phytosanitaires ;
- Le découpage des échantillons devrait se faire au laser plutôt qu’au scalpel, car les lame très aiguisées peuvent laisser des traces significatives de métaux sur le bois (nickel notamment, qui contamine alors l’échantillon) [23] ;
- avoir une bonne connaissance du pH du sol, et si possible de son histoire. Pour la plupart des métaux (plomb et cadmium notamment), le pH du sol joue un rôle majeur dans leur biodisponibilité : plus le sol est acide plus l’arbre absorbera facilement ces 2 métaux. Si le sol est également plus aéré (milieu oxydant), les métaux seront encore plus facilement absorbés que dans un milieu réducteur[24] - [25] ;
- enfin, plus on se rapproche de l’équateur moins les cernes sont visibles (parfois totalement absent), mais des approches similaires à la dendrochronologie sont néanmoins développées, par exemple en s’appuyant sur le taux de calcium du bois de l’arbre Miliusa velutina qui varie dans une tranche ou une « carotte » de tronc à la manière des cernes de croissance[26].
- pour les analyses historiques, lors du croisement de données dendrochimiques et dendrométriques il convient aussi de tenir compte du fait que les cernes de croissance tendent à s’élargir avec le réchauffement climatique (si l’arbre ne manque pas d’eau) et à diminuer lors de périodes froides, comme cela a été montré dans les Vosges à partir d'analyse dendrohronologiques de Sapin argenté (Abies alba Miller) faites 196 placettes[27]
Quels choix d’essences ?
Feuillu ou résineux ? Ces deux types d’arbres ont été testés et utilisés par la dendrochimie.
Selon Rasmussen (1978) les taux de métaux intégrés dans les cellules de l’arbre sont plus élevés dans l'écorce des arbres à feuilles caduques que chez les conifères[28], mais au sein de chaque groupe, certaines essences captent mieux que d’autres les métaux ou d’autres polluants.
L'acidification des sols (par les aiguilles) peut être un facteurs de confusion chez les résineux, car l'acidité accroît significativement la biodisponibilité du Pb et elle s'ajoute ici à l'acidification liée à la pollution de l'air et des eaux météoritiques[29]. Une mobilité radiale post-dépôt (du Plomb par exemple) dans le xylème est parfois possible, il faut alors en tenir compte[29].
Résineux
- l'Épicéa commun : Picea abies L. est une espèce assez largement répartie sur la planète. Il s'est mont montrés efficaces comme archives géochimique et historique potentielles, par exemple pour une étude de la pollution de l’air par le plomb entre 1960 et 1990 sur 3 sites de République tchèque. Les épicéas proches de source de pollutions étaient très chargés en plomb, avec un historique de pollution conservé par les cernes de croissance, alors que les épicéas vivant à 150 km des zones polluées dans un parc national étaient totalement « propres » et les l’étude a montré que dans une zone de tourbières ombrotrophes (c’est-à-dire uniquement alimentées par la pluie) le plomb géologique du substrat rocheux était presque absent du xylème (il aurait sinon pu être un facteur de confusion). Et à 5 km de centrales au charbon, les épicéas contenaient une grande proportion de Plomb (Pb) provenant du charbon comme le montrait son ratio isotopique (ratio élevé de 206 Pb / 207 Pb de 1,19)[29].
Feuillus
Selon Patrick et al. en 2006, l'érable sycomore n'est pas approprié pour suivre le plomb « dans les zones sans grand apport local de plomb, bien qu'il puisse révéler certaines informations sur l'influence temporelle et spatiale des émetteurs de source ponctuelle »[30].
Utilisations de l’analyse des cernes
Pour des historiens
Des pics anormaux de certains minéraux (ex phosphore) dans les anneaux de bois anciens peuvent révéler des explosions volcaniques anciennes et aider à les dater plus précisément via la dendrochronologie [31], par exemple pour l’éruption du Mount Hood, un stratovolcan situé dans le nord de l’État américain de l'Oregon. Dont la dernière éruption a pu être daté de 1781 [32]
Pour reconstituer des évènements de pollution de nappe superficielle
Comme les racines des arbres s’alimentent en eau en partie dans la nappe phréatique superficielle, la dendrochimie peut aussi retracer des pollutions de ces nappes[33]. Elle peut suivre d’autres polluants que des métaux. Par exemple des solvants chlorés ont aussi été quantifiés dans les cernes du bois, sur un ancien site industriel de Verl (Allemagne) pour reconstituer le passé de contamination d'eaux souterraines , mettant en évidence entre 1900 et 2010) plusieurs épisodes de pollution par des solvants chlorés[34]. Du chlore peut aussi provenir de sels de déneigement. En cas de combustion de ce bois ou d’incendie, ce chlore peut produire des dioxines et des furanes.
Pour la bioindication
La dendrochimie est l’un des outils de la bioindication générale, utilisée par exemple pour l’écologie rétrospective, l’écotoxicologie, l’évaluation environnementale ou en santé environnementale[35] et de la bioindication[36], en complément du « phytoscreening » qui lui s’intéresse plutôt à la contamination récente (totale ou partielle) des plantes[37]. Il est parfois aussi utilisé pour la recherche de causes environnementales éventuelles d’épidémies de maladies non infectieuses (leucémies par ex)[38].
En épidémiologie ou écoépidémiologie
A titre d’exemple d’utilisation de la dendrochimie dans le domaine de la santé environnementale :
- La prévalence de certaines maladies pédiatriques respiratoires a pu être mise en relation avec l’évolution locale de la pollution, telle que « mémorisée » par les écorces de frêne (Fraxinus pennsylvanica), dans le cadre d’un essai de biomonitoring d’éléments trace réalisé dans 10 sites différents proches de centres de soins de santé de la ville de Córdoba, (Argentine) Plusieurs « facteurs » ont été séparés : 1) pollution industrielle, particules provenant des sols, 3) pollution automobile, qui ont respectivement pu être associées à 1) un risque allergique accru, 2) la rhinite allergique, 3) les infections respiratoires. Les auteurs, concluant que l’analyse des écorces peut servir au biomonitoring de l'exposition humaine à certains polluants aéroportés [39].
- Des cas inexpliqués de clusters de leucémies infantiles sont apparus aux États-Unis (dont à Fallon, Sierra Vista et Elk Grove). Pour tenter de les expliquer, une étude a mesuré les métaux et métalloïdes "archivés" dans les cernes des arbres durant leur croissance (dendrochimie), afin de savoir si ces enfants ou leurs parents avaient été anormalement et récemment exposés à un métal ou métalloïde (ou plusieurs).
Le seul point commun significatif aux 3 clusters les plus importants - pour les teneurs en éléments traces métalliques du bois des arbres de tous les sites concernés (parmi les nombreux éléments mesurés)- était une augmentation du taux de tungstène au fur et à mesure des années (doublement dans un cas)[40].
Une étude des CDC sur des tissus humains d'habitants de Fallon a confirmé des taux élevés de tungstène et une étude USGS sur l'eau potable de la ville a aussi montré une teneur élevée en tungstène. L'air extérieur filtrés à Sierra Vista contenait aussi plus de tungstène que dans plusieurs régions voisines (sud de l'Arizona). Plusieurs études ont montré au moins un lien possible entre le tungstène et la leucémie (ou le cancer plus généralement)[40].
Principes techniques
La méthode repose sur la possibilité (depuis les années 1970 au moins) d’analyser les teneurs de chaque cernes du bois et grâce à la dendrochronologie de les attribuer à une période du passé.
Ainsi dans les années 1970, l’écorce et le suber contenait beaucoup de plomb issu de l’essence plombée (microparticules de 3 à 13 µm). Une petite partie de ce plomb persiste ensuite, dans les cernes du bois d’arbres poussant en zone tempérée et froide.
Les cernes anciens ne présentent pas d’intérêt pour le suivi de polluants très dégradables, très volatiles ou à forte décroissance radioactives (iode de Tchernobyl) par exemple, mais ils mémorisent très bien, outre des indices météorologiques (cernes plus fins voire quasi absents les années sèches ou très sèches) certains épisodes passés de pollution de l’air, de l’eau et/ou des sols. Inversement, l’analyse de l’écorce et des dépôts sur l’écorce peut fournir des informations complémentaires sur la pollution récente ou actuelle.
Dendrochimie, dendrogéochimie, dendrobiogéochimie…
Dans la plupart des milieux boisés, l’arbre absorbe normalement naturellement peu de métaux lourds ou métalloïdes toxiques via ses racines. Par contre dans les milieux très pollués ils peuvent en concentrer. De même dans les milieux acidifiés, les métaux se montrent très « bioassimilables » et les arbres peuvent alors en accumuler (au point parfois d’en mourir ou - plus souvent - de rendre leur futur bois mort toxique ou source de contamination de la chaine alimentaire via les larves d’insectes saproxylophages, et via les champignons décomposeurs qui vont concentrer ces métaux). La contamination peut dater de décennies ou siècles précédents[41].
Les cernes d’un arbre vivant ou morts ont - alors que les années passaient - pu accumuler et fixer divers polluants, dont métaux lourds (ex : plomb), métalloïdes (ex : arsenic) et radionuléides que l’arbre a pu acquérir via ses feuilles, son écorce ou surtout via ses racines, lesquelles sont généralement connectées à un vaste réseau de mycélium qui leur permet de capter des nutriments (ou polluants le cas échéant) jusqu’à plusieurs dizaines de mètres autour de la base de l’arbre et parfois en profondeur. Exceptionnellement, des racines peuvent aussi s’insinuer dans des égouts ou bassins de décantation et directement y capter des nutriments et/oàu divers polluants.
Méthode
On utilise par exemple des morceaux d’écorces et des carottes de bois prélevées à 1,30 m dans le tronc, pour retracer des pollutions anciennes, via des mesures micro-élémentaires ensuite faites en laboratoire par des techniques de spectrométrie permettant une mesure semi-quantitative d’une large gamme d’éléments, couplées avec une interface d’imagerie (microscope électronique à balayage). Les cernes peuvent en laboratoire être soigneusement détachés les uns des autres et analysés un par un, de manière à reconstituer la pollution passée Cette méthode peut permettre de suivre divers polluants ou de s’intéresser à un polluant ou à un évènement particulier (par ex pour retracer une pollution, par le chrome hexavalent, hautement toxique [42].
Cernes et acidification : l’étude rétrospective des cernes peut apporter des informations fiables sur la date de début de I'acidification du site où l’arbre a grandi, sur l’impact biogéochimique de l’évènement qui est à l’origine de l’acidification, et – si l’on dispose d’un nombre pertinent d’échantillons – la forme de l’évolution spatiotemproelle de I'acidification. Au début des années 2000, des indicateurs dendrochimiques de variations spatiotemporelles de l’acidité de milieux forestiers ont été mis au point[43]
Autre pollutions : On a ainsi pu montrer que l’écorce, les cernes, ou les souches d’arbres anciens peuvent parfaitement avoir « mémorisé » des pollutions anciennes, et dans leurs cernes avoir retenu un « calendrier » des variations de pollutions de l’air (par exemple par le plomb de l’essence). Les évènements mémorisés peuvent dater de décennies ou de siècles ou millénaires ;
Plusieurs études ont montré que la pollution de l’air, du sol ou des eaux superficielles « marque » définitivement les arbres. Par exemple :
- le plomb accumulé dans les cernes formés dans les années 1960-1970 puis disparaissant peu à peu dans les cernes plus jeunes, à la suite de l’interdiction du plomb tétraéthyl comme additif de l’essence marque l’histoire de la formulation de ce carburant. Rem : le phénomène est très net dans les arbres urbains, de bords de routes ou d’autoroutes, ou proches de station essence , ce qui a permis de confirmer que cette pollution est géographiquement très marquée.
- le drainage minier acide (DMA) ou le drainage minier rocheux (DRA) est source de pollution : le drainage acide est issu de l’oxydation du fer et du soufre contenus dans les minéraux sulfures fraichement mis à jour. Il survient généralement à la suite d'activités minières, des constructions routières, ferroviaires ou de canaux, ou d’autres formes d’excavations, de dynamitage ou après réutilisation de stériles minières riche en soufre[44] - [45], ou encore à la suite d'un glissement de terrain, d'un effondrement de falaise, d'un éboulement dans un gouffre, etc.). Cette oxydation produit de l’acide sulfurique pur. Cet acide solubilise des métaux, acidifie l’eau et favorise grandement le transfert, parfois rapide de métaux éventuellement très toxiques dans l’environnement proche ou à l’aval d’un cours d’eau. Ces polluants sont absorbés et conservés dans les cernes des arbres qui y vivent ou survivent ; la dendrogéochimie a ainsi été utilisée au Canada sur l’épinette noire (Picea mariana (Mill.) comme indicateur spatio-temporel de séquelles minières. Elle a permis de rétrospectivement chez des arbres ayant commencé à pousser au début du XXe siècle de reconstituer la cause et l’historique évolutif d’une pollution par DRA à la suite de la construction dans les années 1970 d’une route (Dempster Highway) dans un paysage de roches riches en soufre. Ces cernes ont aussi pu être comparés à ceux d’arbres poussant dans le même environnement mais loin de la route[46]. Les auteurs notent que le cuivre est resté stable dans les cernes du bois, mais que dans les arbres ayant poussé dans la zone de drainage acide, les teneurs en Ni, Zn, As, Sr, Cd et Pb ont très vite augmenté dans les cernes, avant de décroitre durant plusieurs décennies. L’étude a aussi montré que ces arbres ont alors ralenti leur croissance annuelle et que leur mortalité a augmenté par rapport à celles d’arbres situés hors de la zone de drainage acide. Ces métaux seront relargués des décennies ou siècles plus tard quand le bois se décomposera ou brûlera.
Références
- Grodzinsky D.M (1995) Ecological and biological consequences of Chernobyl catastrophe. 4. In: Bar’yakhtar, V. G. (Ed.), Chernobyl Catastrophe: History, Social, Economics, Geochemical, Medical and Biological Consequence (“Naukova Dumka”, Kiev) [(http://www.stopatom.slavutich.kiev.ua en Russe]) Alexei Yablokov, Vassili et Alexei Nesterenko ; Chernobyl ; Consequences of the Catastrophe for People and the Environment ; Annals of the New york Academy of sciences ; Vol. 1181, Consulting editor J.D. sherman-Nevinger ; en anglais, (ISSN 0077-8923) [impression]; (ISSN 1749-6632) [en ligne], 349 pages, PDF, 4,3Mo) et Index des mots clé (39 pages, 165 Ko)
- Trüby, P., 1988. Bleiverteilungen in Waldbäumen unt erschiedlich belasteter Standorte. Angewandte Botanik 62, 93-104
- Schulz, H., Huhn, G., Schüürmann, G., Niehus, B., L iebergeld, G., 1997. Determination of throughfall rates on the basis of pine bark loads: results of a pilot field study. Journal of the Air & Waste Management Association 47, 510-516
- Doucet, A. (2011). L’arbre: un registre naturel de la pollution atmosphérique. capsules INRSciences, (10), 1-7. http://espace.inrs.ca/6856/1/2011-10.pdf
- Paul G. Rodewald, Melissa J. Santiago, Amanda D. Rodewald (2005), “Habitat use of breeding red-headed woodpeckers on golf courses in Ohio” ; Wildlife Society Bulletin 33(2):448-453. 2005 ; doi: 10.2193/0091-7648(2005)33[448:HUOBRW]2.0.CO;2 (Résumé )
- voir Figure 1 ; Composition du suber de frênes ayant poussé dans du terreau en atmosphère contrôlée (= valeurs de références) in https://tel.archives-ouvertes.fr/tel-00554894/document p 90/207
- El-Hasan, T., Al-Omari, H., Jiries, A., & Al-Nasir, F. (2002). « Cypress tree (Cupressus sempervirens L.) bark as an indicator for heavy metal pollution in the atmosphere of Amman City, Jordan ». Environment International, 28(6), 513-519.
- Heichel, G.H. and Hankin, L. (1972) Particles containing lead, chlorine and bromine detected on trees with an electron microprobe. Environ. Sci and Tech ;6 (13), 1121-1128.
- Barnes, D., Hamadah, M.A., Ottaway, J.M., (1976) The lead, copper and zinc content of tree rings and barks. A measurement of local metallic pollution. The Science of the Total Environment 5, 63-77.
- Mickaël Catinon. Détermination de la pollution atmosphérique métallique : étude critique de l’utilisation des écorces d’arbres. Océan, Atmosphère. Université Joseph-Fourier - Grenoble I, (2010). Français. <tel-00554894>https://tel.archives-ouvertes.fr/tel-00554894/document ; voir , p 95/207
- Kreiner, W., & Härtel, O. (1986). Spruce bark influenced by SO2. European journal of forest pathology, 16(3), 171-181. résumé
- Jeremy Hance (2013) Une nouvelle théorie météorologique avance que les forêts sont génératrices de pluie on 27 août 2013
- Novoa-Munoz JC, Pontevedra-Pombal X, Martinez-Cortizas A, Garcia-Rodeja Gayoso E (2008) Mercury accumulation in upland acid forest ecosystems nearby a coal-fired powerplant in Southwest Europe. Sci Total Environ 423:303–312
- Kawabe H, Yashiro M, Kourai H, Mamada S (1991) Mercury distribution in trees at a contaminated site in Japan. Environ Sci Pollut Manag, pp 381–387
- Fleck JA, Grigal DF, Nater EA (1999) « Mercury uptake by trees : an bservational experiment ». Water Air Soil Pollut 115(1–4):513–523
- Siwik EIH, Campbell LM, Mierle G (2010) Distribution and trends of mercury in deciduous tree cores. Environ Pollut 158(6):2067–2073
- Wright, G., Woodward, C., Peri, L., Weisberg, P. J., & Gustin, M. S. (2014). Application of tree rings [dendrochemistry for detecting historical trends in air Hg concentrations across multiple scales]. Biogeochemistry, 120(1-3), 149-162.
- Siwik E.I, Campbell L.M & Mierle G (2010) Distribution and trends of mercury in deciduous tree cores. Environmental Pollution, 158(6), 2067-2073
- Becnel J, Falgeust C, Cavalier T, Gauthreaux K, Landry F, Blanchard M, Beck MJ, Beck JN (2004) Correlation of mercury concentrations in tree core and lichen samples in southeastern Louisiana. Microchem J 78(2):205–210
- Abreau SN, Soares AMVM, Nogueira AJA, Morgado F (2008) Tree rings, populous nigra L., as mercury data logger in aquatic environments: case study of an historically contaminated environment. Bull Environ Contam Toxicol 80: 294–299
- Hojdova M, Navratil T, RohovecJ, ZakK, Vanek A, Chrastny V, Bace R, Svoboda M (2011) « Changes in mercury depo- sition in a mining and smelting region as recorded in tree rings ». Water Air Soil Pollut 216:73–82
- Cutter, B.E., Guyette, R.P. (1993) Anatomical' chemical and ecological factors affecting tree species choice in dendrochemistry studies. Journal of Environmental Quality, 22: 611-619
- Sheppard, P. R., & Witten, M. L. (2005). « Laser trimming tree-ring cores for dendrochemistry of metals ». Tree-Ring Research, 61(2), 87-92.
- Kabata-Pendias, A. (2004). Soil–plant transfer of trace elements—an environmental issue. Geoderma, 122(2-4), 143-149.
- Kabata‐Pendias, A., & Sadurski, W. (2004). Trace elements and compounds in soil. Elements and their compounds in the environment: Occurrence, analysis and biological relevance, 79-99 (chap 5 in « Elements and Their Compounds in the Environment: Occurrence, Analysis and Biological Relevance », Second Edition).
- Poussart, P. M., Myneni, S. C. B., & Lanzirotti, A. (2006). Tropical dendrochemistry: A novel approach to estimate age and growth from ringless trees. Geophysical Research Letters, 33(17).
- Becker M (1989) The role of climate on present and past vitality of silver fir in forests in the Vosges mountains of north-eastern France. Can. J. for. Res. 19: 1110-1117
- Rasmussen L (1978) Element content of epiphytic Hypnum cupressiforme related to element content of the bark of different species of phorophytes. Lindbergia 4, 209-218.
- Novak, M., Mikova, J., Krachler, M., Kosler, J., Erbanova, L., Prechova, E., ... & Fottova, D. (2010). Radial distribution of lead and lead isotopes in stem wood of Norway spruce: A reliable archive of pollution trends in Central Europe. Geochimica et Cosmochimica Acta, 74(15), 4207-4218. URL: https://www.academia.edu/download/42726827/Radial_distribution_of_lead_and_lead_iso20160216-9318-1t0kw5r.pdf
- (en) Gavin J. Patrick et John G. Farmer, « A stable lead isotopic investigation of the use of sycamore tree rings as a historical biomonitor of environmental lead contamination », Science of The Total Environment, vol. 362, nos 1-3, , p. 278–291 (DOI 10.1016/j.scitotenv.2005.12.004, lire en ligne, consulté le )
- Pearson C, Manning SW, Coleman M, Jarvis K (2005) Can tree-ring chemistry reveal absolute dates for past volcanic eruptions? J Archaeol Sci 32:1265–1274 (résumé)
- . Sheppard, P. R., Weaver, R., Pringle, P. T., & Kent, A. J. (2010) Dendrochemical evidence of the 1781 eruption of Mount Hood, Oregon. In Tree Rings and Natural Hazards (pp. 465-467). Springer, Dordrecht. URL : https://www.researchgate.net/profile/Markus_Stoffel2/publication/235665547_Tree_rings_and_natural_hazards/links/55c2609d08aeb975673e4299.pdf#page=439
- Vroblesky D.A, Yanosky T.M (1990) Use of tree-ring chemistry to document historical ground-water contamination events. Ground Water, 28 (5), 677−684
- Balouet, J. C., Burken, J. G., Karg, F., Vroblesky, D., Smith, K. T., Grudd, H., ... & Chalot, M. (2012). Dendrochemistry of multiple releases of chlorinated solvents at a former industrial site. Environmental science & technology, 46(17), 9541-9547.
- Lewis, T. E. (1993). Dendrochronology and dendrochemistry in regional ecosystem health assessments: the forest health monitoring experience. Proceedings: Tree Rings as Indicators of Ecosystem Health, 25, 1-16.
- Burken J.G., Vroblesky, D. A., & Balouet, J. C. (2011). Phytoforensics, dendrochemistry, and phytoscreening: new green tools for delineating contaminants from past and present. URL résumé : https://pubs.acs.org/doi/abs/10.1021/es2005286
- Limmer & al 2013 « Directional Phytoscreening: Contaminant Gradients in Trees for Plume Delineation" |Environ. Sci. Technol., 2013, 47 (16), pp 9069–9076 DOI: 10.1021/es400437q |23 juillet | URL résumé : https://pubs.acs.org/doi/abs/10.1021/es400437q
- Sheppard, P. R., & Witten, M. L. (2003, December). Dendrochemistry of urban trees in an environmental exposure analysis of childhood leukemia cluster areas. In AGU Fall Meeting Abstracts. | URL Résumé : http://adsabs.harvard.edu/abs/2003AGUFM.B12F..07S
- Wannaz, E. D., Carreras, H. A., Perez, C. A., & Pignata, M. L. (2011). « Relationship between trace elemental composition in Fraxinus pennsylvanica bark and the incidence of some respiratory diseases in Cordoba, Argentina ». International Journal of Environment and Health, 5(1-2), 60-71 (résumé)
- Sheppard P.R & Witten M.L (2003) Dendrochemistry of urban trees in an environmental exposure analysis of childhood leukemia cluster areas. In AGU Fall Meeting Abstracts (décembre) (résumé)
- Truby P (1988). « Bleiverteilungr in Waldbaumen unterschiedlich belasteter standorte ». Angew Bot;62:93–104
- Drava, G., Anselmo, M., Brignole, D., Giordani, P., & Minganti, V. (2017). Branch bark of holm oak (Quercus ilex L.) for reconstructing the temporal variations of atmospheric deposition of hexavalent chromium. Chemosphere, 170, 141-145 (résumé)
- Dupouey J.L., Rose C., Bailly R., Behr P., Ponton S. et Weitner A. (2009). Mise au point d’indicateurs dendrochimiques des variations spatiales et temporelles de l’acidité des milieux forestiers. Rapport final du contrat DAEME n° 0562C0030. 26 p.
- Filion, M.P. & Ferguson, K. (1989) Acid mine drainage research in Canada. In Proceedings 6 Annual Meeting of BIOMINET (R.G.L. McCready, ed.). CANMET Publication, 89-90 : 27-44. Natural Resources Canada, Ottawa, Ontario.
- Gould, W.D. & Kapoor A. (2003) Chapter 10: The microbiology of Acid mine drainage. In Environmental Aspects of Mine Wastes. Edité par J.L. Jambor, D.W. Blowes & I.M. Ritchie. Short Course Handbook Vol. 31, Mineralogical Association of Canada, Ottawa, p. 203-226.
- https://ruor.uottawa.ca/bitstream/10393/27835/1/MR49192.PDF voir chap4.1.5 p 41 sur 103
Voir aussi
Articles connexes
Bibliographie
- Bellis D.J, Satake K & McLeod C.W (2004) A comparison oflead isotope ratios in the bark pockets and annual rings of two beech trees collected in Derbyshire and South Yorkshire, UK. Science ofthe Total Environment, 321 : 105-113.
- Cheng Z, Buckley B.M, Katz B, Wright W, Bailey R, Smith K.T, Li J, Curtis A van Geen, A (2007) Arsenic in tree rings at a highly contaminated site. Science of the Total Environment, 376: 324-334.
- Duplessis P (2010) Analyse des métaux lourds des cernes de croissance du frêne de Pennsylvanie (Fraxinus pennsylvanica Marsh.) en plaines alluviales affectées par la contamination (Sud du Québec, Canada) (Doctoral dissertation, Université du Québec à Trois-Rivières) URL :http://depot-e.uqtr.ca/1186/1/030140255.pdf.
- Guyette R.P, Cutter B.E, Henderson G.S (1991) Long-term correlations between minning activity and levels of lead and cadmium in tree-rings of eastem red-cedar. Journal of Environmental Quality, 20: 146-150.
- Houle, D., Duchesne, L., Moore, l-D., Richer-Laflèche, M., Ouimet, R. (2002) Soil and tree-ring chemistry response to liming in a sugar maple stand. Journal of Environmental Quality, 31: 1993-2000.
- Legge, A.H., Kaufmann, H.C., Winchester, J.W. (1984) Tree-ring analysis by PIXE for a historical record of soil chemistry response to acidic air pollution. Nuc1ear Instruments and Methods in Physics Research, B3, pp 507-510.
- McClenahen, J. R., Vimmerstedt, J. P. (1993) Soil, climate and atrnospheric deposition relationships with elemental concentration in annual rings of tuliptree. Journal of Environmental Quality, 22: 23-32.
- Medeiros, J. G.S., Tomazello, Fo. M., Krug, FJ., Vives, A. E.S. (2008) Tree-ring characterization of Araucaria columnaris Hook and its applicability as a lead indicator in environmental monitoring. Dendrochronologia, 26: 165-171.
- Nuhoglu, Y. (2006) A New Approach to Air Pollution Determination Using Annual Rings: Dendro-Chemical ElementaI Analysis of Annual Rings by SEM-EDS. Polish Journal of environmental studies, Vol. 15, No. 1, 111-119.
- Padilla, K.L., Anderson, K.A. (2002) Trace element concentration in tree-rings biomonitoring centuries o f environmental change. Chemosphere, 49: 575-585.
- Patrick, G.J., Farmer, J.G. (2006) A stable lead isotopic investigation of the use of sycamore tree rings as a historical biomonitor of environmental lead contamination. Science of the Total Environment, 362: 278-291.
- Pearson, C., Manning, S.W., Coleman, M., Jarvis, K. (2005) Can tree-ring chemistry reveal absolute dates for past volcanic eruptions? Journal of Archaeological Science, 32: 1265-1274.
- Penninckx, y., Glineur, S., Gruber, W., Herbauts, J., Meerts, P . (2001 ) Radial variations in wood mineraI element concentrations: a comparaison of beech and pedunculate oak form the Belgian Ardennes. Annals of Forest Science, 58: 253-260.
- Smith KT & Shortle W.C (1996) Tree biology and dendrochemistry. In: Dean, J.S., Meko, D.M., Swetnam, T.W. (Eds), Tree Rings, Environment and Humanity. Radiocarbon, University of Arizona, Tucson, pp. 629-635. |URL : http://www.ltrr.arizona.edu/~sheppard/dendrochemistry/SmithShortle1996.pdf
- St-Laurent J (2006). Application de la dendrochronologie et de la dendrogéochimie et essai du plomb 210 pour la datation d'événements de contamination des berges des rivières Saint-François et Massawippi aux hydrocuarbures (Centre-Sud du Québec) (Doctoral dissertation, Université du Québec à Trois-Rivières). URL : http://depot-e.uqtr.ca/1202/1/000135704.pdf
- Southerland S (2001) Dendrochemical Analysis of Lead, Aluminum, and Calcium in Southem Appalachian American Beech. A Thesis Presented to the Faculty of the Department of Environmental Health East Tennessee State University. Tennessee State University.
- Watmough S.A & Hutchinson T.C (2002) Historical changes in lead concentrations in tree-rings of sycamore, oak and Scots pine in north-west England. The Science of the Total Environment, 293: 85-96.
- Watmough S.A (1997) An evaluation of the use of dendrochemical analyses ln environmental monitoring. Environmental Review, 5: 181-201
- Yanosky, T.M., Hansen, B.P., Schening, M.R. (2001) Use oftree rings to investigate the onset of contamination of a shallow aquifer by chlorinated hydrocarbons. Journal of Contaminant Hydrology, 50: 159-173.
- Yanosky, T.M., Vroblesky, D.A. (1995) Element analysis of tree rings in ground-water contamination studies. Dans Lewis, T.E. (Ed.), Tree rings as indicators of ecosystem health. CRC Press, Boca Raton, FI, pp. 177-205.