Dénaturation
En biochimie, la dénaturation est le processus par lequel une macromolécule biologique, acide nucléique ou protéine, perd sa conformation tridimensionnelle normale : les protéines perdent leur repliement et se déplient, les deux brins appariés des duplex d'acides nucléiques se séparent. Cette conformation tridimensionnelle est le plus souvent nécessaire pour que les macromolécules biologiques puissent remplir leur fonction et donc la dénaturation inactive en général ces macromolécules biologiques.
Dénaturation des acides nucléiques
L'ADN est dit dénaturé lorsque les deux brins complémentaires dont il est normalement constitué sont disjoints. On obtient ce résultat par exemple en augmentant la température, ou en ajoutant des agents chaotropiques comme l'urée. Lorsque la dénaturation est effectuée par chauffage, la température à laquelle la moitié des molécules d'ADN est dénaturée est appelée température de fusion moléculaire. La dénaturation a lieu lorsque les chocs dus à la température parviennent à rompre les liaisons hydrogène liant les deux brins. Lorsque la température redescend, les chaînes complémentaires se réassocient deux par deux avec réapparition des liaisons H. La composition nucléotidique de la chaine a un effet sur la température de fusion : des chaînes contenant beaucoup de bases C et G (impliquant trois liaisons H entre les nucléotides en vis-à-vis sur les deux brins) sont plus stables et donc plus difficiles à dénaturer que des chaines contenant plus de bases A et T (deux liaisons).
La renaturation est l'opération inverse de ré-association des deux brins de l'ADN qui se recombinent en une seule molécule bicaténaire. La dénaturation de l'ADN peut se faire avec un thermocycleur.
L'ARN peut également adopter une structure complexe comprenant des appariements de base et lui permettant d'accomplir des fonctions variées (catalyse, reconnaissance moléculaire...). Cette structure peut être rompue par les mêmes procédés physico-chimiques que pour l'ADN (température, agents chaotropiques)
Dénaturation des protéines
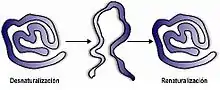
La dénaturation d'une protéine correspond à la désorganisation de la structure spatiale sans rupture des liaisons covalentes et en particulier des liaisons peptidiques, car seules les liaisons secondaires sont concernées. La chaîne polypeptidique est alors partiellement ou totalement dépliée.
Conséquences de la dénaturation
La dénaturation d'une protéine a le plus souvent plusieurs conséquences importantes :
- perte de l'activité biologique. L'activité biologique des protéines, en particulier des enzymes, dépend fortement de l'organisation spatiale des acides aminés qui la compose, par exemple au niveau d'un site actif. La perte du repliement entraîne alors une perte d'activité ;
- changement des propriétés optiques. Plusieurs caractéristiques peuvent être affectées : l'absorption dans l'UV, la fluorescence et le dichroïsme circulaire. Les deux premiers effets résultent d'un changement de polarité de l'environnement des chromophores comme le tryptophane, qui passent d'un environnement hydrophobe (le cœur de la protéine) à un environnement polaire (le solvant aqueux). Le dernier effet est lié à la perte des structures secondaires, hélices α et feuillets β ;
- modification de la solubilité. La solubilité dépend de la surface d'interaction entre la protéine et l'environnement aqueux. La modification de la structure spatiale affecte profondément cette surface d'interaction et modifie donc la solubilité. En particulier, des contacts entre zones hydrophobes de la protéine dépliée peuvent conduire à l'agrégation non ordonnée des protéines : floculation quand la dénaturation est réversible (exemple : floculation du lait en présence d'un acide), coagulation quand la dénaturation est irréversible (coagulation des caséines du lait en caillé, coagulation du collagène lors de la cuisson des viandes, des poissons, coagulation de l'ovalbumine lors de la cuisson des œufs). La gélification des protéines (établissement d'un réseau gélifié qui repose notamment sur la formation de ponts disulfures : pâtes de pâtisserie, pâtes à pain), correspondant à l'agrégation lente de protéines dénaturées en un réseau tridimensionnel ordonné, nécessite une masse insoluble bien hydratée[1].
Agents dénaturants
Les agents dénaturants sont nombreux et peuvent être soit de nature physique, soit des agents chimiques.
Agents physiques


- La température : L'augmentation de la température engendre une agitation thermique des atomes de la molécule. Celle-ci provoque une rupture des interactions intermoléculaires, comme les liaisons hydrogène, qui stabilisent la structure spatiale. En effet, les liaisons hydrogène servent à stabiliser les protéines dans une forme tridimensionnelle où elles peuvent remplir leurs fonctions. À haute température, les liaisons hydrogène sont brisées et ne peuvent plus assurer le maintien de la forme de la protéine, qui n'est alors plus fonctionnelle. La plupart des protéines sont ainsi dénaturées à partir de 41 degrés Celsius, ce qui explique la dangerosité chez l'humain de fortes fièvres[2]. Ce processus est à l'origine de la coagulation de l'ovalbumine, protéine du blanc d'œuf, lorsqu'on fait cuire des œufs.
- Modification du pH : elle entraine une modification des charges portées par les groupements ionisables et altère donc les liaisons ioniques et hydrogène stabilisant la structure spatiale.
- Les radiations.
Agents chimiques
- Les agents chaotropiques comme l'urée ou le chlorure de guanidine. À forte concentration, ces composés fragilisent fortement les liaisons hydrogène (principales liaisons de faibles énergies responsables du maintien des structures secondaires, tertiaires et quaternaires des protéines).
- Les agents réducteurs de thiols comme le 2-mercaptoéthanol ou le DTT (Dithiothréitol). Ils permettent la réduction (rupture) des ponts disulfures et peuvent ainsi contribuer à fragiliser la structure tertiaire ou quaternaire des protéines
- Les bases et les acides, par altération du pH (voir ci-dessus, « Agents physiques »).
- Les détergents, par modification de l'interaction avec le solvant aqueux.
- Les ions de métaux lourds.
Notes et références
- Hervé This, Révélations gastronomiques, Belin, , p. 311-317.
- (en) « Denaturation », sur Chemistryexplained.com, (consulté le ).
Voir aussi
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :