Coagulation du lait
La coagulation du lait (ou caillage) est provoquée par la dénaturation de la caséine, protéine majoritaire du lait. La matière grasse et les séroprotéines ont un rôle passif.
Les différentes caséines sont organisées en micelles qui sont des agrégats de plusieurs molécules de caséine. C'est un complexe de protéines phosphorées précipitant à pH 4,6, ou bien sous l'action d'enzymes spécifiques — comme la chymosine, extrait de macération de la caillette du veau qui, avec une autre enzyme, la pepsine, forment la présure.
En technologie fromagère on distingue donc deux types de coagulations[1] :
- la coagulation lactique ou coagulation acide (voie fermentaire).
- la coagulation présure (voie enzymatique).
Coagulation lactique
Dans le lait, les micelles de caséines et les globules gras sont chargés négativement. Ceci entraîne une répulsion électrostatique qui assure la stabilité du lait. Les fragments de caséine sont hydrophiles et se trouvent en périphérie des micelles, où ils créent une couche d'hydratation (eau retenue empêchant le rapprochement des colloïdes entre eux). L'acide lactique, issu de la dégradation du lactose par les bactéries lactiques, porte des charges positives qui neutralisent les charges négatives des colloïdes. À pH 4,6 -- appelé point isoélectrique de la caséine[2] -- on obtient leur neutralité. L'acide déshydrate ainsi les micelles, ce qui leur permet de se rapprocher. Plus la déminéralisation (acidification du lait par des bactéries lactiques ou coagulation acide[1]) est importante, plus c'est un caillé de type lactique. En effet, les micelles se lient par des interactions hydrophobes (liaisons faibles, réversibles) en retenant dans leur réseau les globules gras, les micro-organismes, les vitamines, toutes les particules qui peuvent être retenues dans les mailles du réseau caséinique. On obtient un gel : c'est la coagulation lactique du lait (lait fermenté).
Coagulation présure

La présure animale est constituée de deux enzymes dont la proportion varie selon l’âge de la bête : la chymosine et la pepsine. Cette dernière n'agit pas principalement sur la coagulation du lait. En général, la présure commerciale est très majoritairement composée de chymosine (à au moins 85 %). Il existe également des présures végétales, microbiennes et de synthèse[3].
La plupart des fromageries fabriquant des fromages bénéficiant d'une Appellation d'Origine Protégée (AOP), notamment en Suisse, utilisent de la présure animale.
Actuellement, dans l'industrie laitière, des coagulants de synthèse sont obtenus à partir de microorganismes génétiquement modifiés (OGM[4]). De nombreux fromages « modernes » utilisent ce type de coagulants.
La stabilité des micelles de caséines
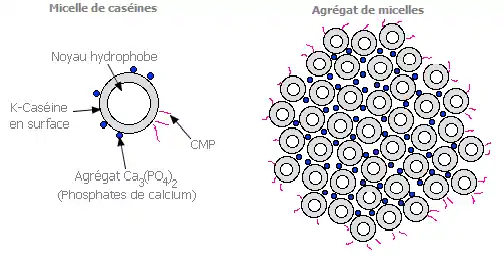
Les caséines sont des protéines qui constituent la majeure partie des composants azotés du lait. Celui-ci étant une émulsion – ici, un mélange aqueux de lactosérum, de globules gras et de micelles de caséines dispersées – il devrait y avoir décantation des éléments au cours du temps. La formation de micelles grâce à la caséine kappa, ou k-caséine, permet une homogénéité du lait et donc une stabilisation de son émulsion.
Les micelles de caséines doivent leur stabilité à deux facteurs :
– La charge de surface : les caséines ont un caractère acide très net. Au pH normal du lait (6,55 pour du lait de vache UHT demi-écrémé)[5], elles ont un fort excès de charges négatives. Les micelles sont alors elles aussi chargées et de fortes répulsions électrostatiques empêchent leur rapprochement.
– Le degré d'hydratation : l'eau fixée par les micelles est importante (3,7g pour 1g de protéines). Une partie de cette eau forme autour de chaque micelle une enveloppe d'hydratation protectrice.
C'est la caséine kappa qui porte les charges négatives et le caractère hydrophile de la caséine. Elle constitue ainsi la tête hydrophile. Les autres caséines ne constituent pas la tête des micelles, qui se repoussent les unes des autres, empêchant ainsi tout agrégat.
La phase primaire ou phase enzymatique
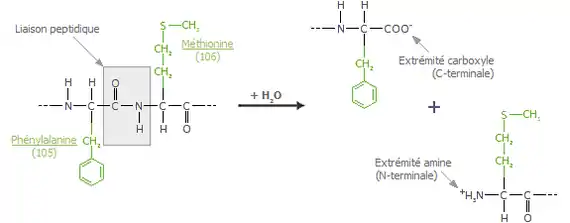
Il existe différentes enzymes capables d'hydrolyser la liaison Phe(105)-Met(106)[6] de la k-caséine. Cette hydrolyse coupe la molécule en deux. On obtient d'une part le CMP (Caseino-Macro-Peptide) hydrophile et soluble, diffusé à l'extérieur de la micelle de caséines ; d'autre part le PCK (Para-Caséine-Kappa) hydrophobe, qui lui reste à l'intérieur. La chymosine est une hydrolase permettant cette coupure protéolytique[7] - [8]. La rapidité du déroulement dépend du pH et de la température. L'action optimale de la présure est à 40 °C et à pH 4,6.
La phase secondaire ou de formation du caillé
La perte des Caséino-Macro-Peptides dans les micelles de caséines fait que les k-caséines ne se repoussent plus : le caractère hydrophobe des micelles augmente. Le fractionnement du phospho caséinate laisse des liaisons libres qui peuvent être occupées par le calcium ionisé (cation bivalent) qui va former des ponts calciques; on pense possible la formation de ponts disulfures. C'est une réaction irréversible qui produit un gel souple : c'est le caillé présure. La vitesse de formation du coagulum ainsi que de son durcissement augmente avec la température. Elle est très faible à 15 °C et très forte à 55 °C. La partie liquide restante est principalement constituée du lactosérum qui est lui-même composé de lactose, de 20 % des protéines du lait, ainsi que de divers molécules et vitamines. Elle est non utilisée en fromagerie.
Cette phase est le début de la synérèse. La synérèse est la contraction du caillé qui peut se faire grâce aux liaisons. Plus elle est avancée, plus le caillé est dur. Elle est très faible pour une coagulation lactique.
Annexes
Articles connexes
Notes et références
- Florian Ronez, Le lait et sa coagulation, extrait thèse de doctorat, 2012
- Nadia Thivierge, Caractérisation de souches de Lactococcus lacfis ssp cremoris pour le développement de ferments mésophiles à aptitudes fromagères élevées (Cheddar), Laval, Canada, Département des aliments et de nutrition, Faculté des sciences de l'agriculture et de l'alimentation, Université Laval, coll. « Mémoire de maitre ès sciences (M. Sc.) », , 85 p. (lire en ligne), p. 3
- « scribd.com/doc/24144901/Agents… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- GNISLes champs d'application du génie génétique dans l'alimentation, OGM.org
- Ce pH a été mesuré par un pH-mètre électronique en laboratoire lors d'une séance de TPE
- Phe(105) signifie une phénylalanine en position 105 de la chaine peptidique, et Met(106) signifie une méthionine en position 106
- "Rennet cleavage at the Phe105-Met106 bond eliminates the stabilizing ability, leaving a hydrophobic portion, para-kappa-casein, and a hydrophilic portion called kappa-casein glycomacropeptide (GMP), or more accurately, caseinomacropeptide (CMP)." - http://www.foodsci.uoguelph.ca/dairyedu/chem.html
- http://www.worldlingo.com/ma/enwiki/fr/K-Casein
- http://www.chups.jussieu.fr/polys/biochimie/DGbioch/POLY.Chp.7.6.html
- http://www.pep.chambagri.fr/caprins/html/contenu/pdf/mail%20du%202dec08/F%20presure_A3-RV.pdf
- « INRAE : recherches pour l'agriculture, l'alimentation et l'environnement », sur inra.fr (consulté le ).
- Voir Structure: The Casein Micelle - http://www.foodsci.uoguelph.ca/dairyedu/chem.html