Cytidine désaminase
La cytidine désaminase est une hydrolase qui catalyse les réactions :
- cytidine + H2O uridine + NH3 ;
- 2'-désoxycytidine + H2O 2'-désoxyuridine + NH3.
| Cytidine désaminase | ||
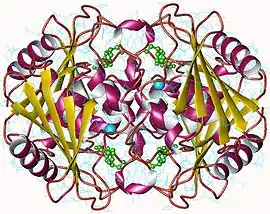 Tétramère de cytidine désaminase humaine avec Zn2+ en bleu et inhibiteur en vert (PDB 1MQ0[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | CDA | |
| N° EC | 3.5.4.5 | |
| Homo sapiens | ||
| Locus | 1p36.12 | |
| Masse moléculaire | 16 185 Da[2] | |
| Nombre de résidus | 146 acides aminés[2] | |
| Entrez | 978 | |
| HUGO | 1712 | |
| OMIM | 123920 | |
| UniProt | P32320 | |
| RefSeq (ARNm) | NM_001785.2 | |
| RefSeq (protéine) | NP_001776.1 | |
| Ensembl | ENSG00000158825 | |
| PDB | 1MQ0 | |
|
GENATLAS • GeneTests • GoPubmed • HCOP • H-InvDB • Treefam • Vega | ||
| Liens accessibles depuis GeneCards et HUGO. | ||
Cette enzyme est codée chez l'homme par le gène CDA. Il s'agit d'un homotétramère qui catalyse la désamination par hydrolyse de la cytidine et de la désoxycytidine en uridine et désoxycytidine respectivement. Il s'agit de l'une des désaminases qui maintiennent le niveau de pyrimidine des cellules.
Cytidine désaminase
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Zn2+ |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Notes et références
- (en) Sang J. Chung, J. Christopher Fromme et Gregory L. Verdine, « Structure of Human Cytidine Deaminase Bound to a Potent Inhibitor », Journal of Medicinal Chemistry, vol. 48, no 3, , p. 658-660 (PMID 15689149, DOI 10.1021/jm0496279, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.
