Couche S
La couche S ou couche de surface cristalline est une enveloppe cellulaire procaryote régulièrement structurée que l'on trouve chez presque tous les types d'archées, ainsi que chez de nombreux types de bactéries[1] - [2]. La couche S des archées et des bactéries est constituée d'une couche monomoléculaire composée d'un assemblage d'une seule (ou, dans certains cas, de deux) protéine(s) ou glycoprotéine(s) identique(s)[3]. Cette structure est construite par auto-assemblage et entoure toute la surface de la cellule. Ainsi, la protéine de la couche S peut représenter jusqu'à 15% de l'ensemble du contenu protéique d'une cellule[4]. Les protéines de la couche S sont peu ou pas conservées, et peuvent varier considérablement, même entre espèces apparentées. Selon les espèces, les couches S ont une épaisseur comprise entre 5 et 25 nm et possèdent des pores identiques de 2 à 8 nm de diamètre[5].
La terminologie "couche S" a été utilisée pour la première fois en 1976[6]. Son emploi général a été accepté lors du "Premier atelier international sur les couches superficielles des cellules bactériennes cristallines" en 1984 à Vienne (Autriche). Par la suite, en 1987, les couches S ont été définies lors de l'atelier de l'Organisation européenne de biologie moléculaire sur les "couches superficielles des cellules bactériennes cristallines", à Vienne, comme "des réseaux bidimensionnels de sous-unités protéiques formant des couches superficielles sur les cellules procaryotes" (voir préface de la référence[7]). Pour obtenir un bref résumé de l'histoire de la recherche sur la couche S, voir les références suivantes[2] - [7].
Localisation des couches S
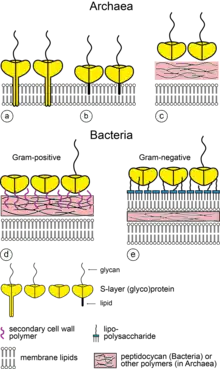
Chez les bactéries à Gram négatif, les couches S sont associées aux lipopolysaccharides par des interactions ioniques, glucides-glucides, protéines-glucides et/ou protéines-protéines[2].
Chez les bactéries à Gram positif dont les couches S contiennent souvent des domaines d'homologie de la couche superficielle (SLH en anglais), la liaison se fait au peptidoglycane et à un polymère secondaire de la paroi cellulaire (par exemple, les acides téichoïques). En l'absence de domaines SLH, la liaison se fait par le biais d'interactions électrostatiques entre l'extrémité N-terminale de la protéine de la couche S, chargée positivement, et un polymère secondaire de la paroi cellulaire, chargé négativement. Chez les Lactobacilles, le domaine de liaison peut être situé à l'extrémité C-terminale[2].
Chez les archées à Gram négatif, les protéines de la couche S possèdent un ancrage hydrophobe qui est associé à la membrane lipidique sous-jacente[1] - [2].
Chez les archées à Gram positif, les protéines de la couche S se lient à la pseudomuréine ou à la méthanochondroïtine[1] - [2].
Fonctions biologiques de la couche S
Pour de nombreuses bactéries, la couche S représente la zone d'interaction la plus externe avec leur environnement respectif[2] - [8]. Ses fonctions sont très diverses et varient d'une espèce à l'autre. Chez de nombreuses espèces d'archées, la couche S est le seul composant de la paroi cellulaire et, par conséquent, est importante pour la stabilisation mécanique et osmotique. Les fonctions additionnelles associées aux couches S incluent :
- la protection contre les bactériophages, les Bdellovibrios, et la phagocytose ;
- la résistance contre les pH bas ;
- une barrière contre les substances de poids moléculaire élevé (par exemple, les enzymes lytiques) ;
- l'adhésion (pour les couches S glycosylées) ;
- la stabilisation de la membrane (par exemple, le SDBC chez Deinococcus radiodurans[9] - [10]) ;
- la résistance au stress électromagnétique (par exemple, les radiations ionisantes et les températures élevées[9] - [10]) ;
- la mise à disposition de sites d'adhésion pour les exoprotéines ;
- la mise à disposition d'un compartiment périplasmique chez les procaryotes à Gram positif avec le peptidoglycane et les membranes cytoplasmiques ;
- des propriétés antisalissures[11] ;
- la biominéralisation[12] - [13] - [14] ;
- un tamis moléculaire et une fonction de barrière[15].
Structure de la couche S
Bien qu'elles soient omniprésentes chez les archées et communes chez les bactéries, les couches S que l'on retrouve chez ces divers organismes ont des propriétés structurelles uniques, notamment la symétrie et les dimensions des cellules unitaires, en raison de différences fondamentales dans les éléments constitutifs[16]. Les analyses de séquence des protéines de la couche S ont permis de prédire qu'elles ont une taille comprise entre 40 et 200 kDa et qu'elles peuvent être composées de plusieurs domaines, dont certains peuvent être structurellement apparentés. Depuis la première mise en évidence d'un réseau macromoléculaire sur un fragment de paroi cellulaire bactérienne dans les années 1950[17], la structure de la couche S a été largement étudiée par microscopie électronique. Les images à moyenne résolution des couches S issues de ces analyses ont fourni des informations utiles sur la morphologie globale de la couche S. Les structures à haute résolution d'une protéine de la couche S archéenne (MA0829 de Methanosarcina acetivorans souche C2A) de la famille des protéines de la couche S des Methanosarcinales et d'une protéine de la couche S bactérienne (SbsB), ainsi que de Geobacillus stearothermophilus souche PV72, ont récemment été déterminées par cristallographie aux rayons X[18] - [19]. Contrairement aux structures cristallines existantes, qui représentaient des domaines individuels des protéines de la couche S ou des composants protéiques mineurs de la couche S, les structures de MA0829 et de SbsB ont permis de proposer des modèles à haute résolution des couches S de M. acetivorans et de G. stearothermophilus. Ces modèles présentent une symétrie respectivement hexagonale (p6) et oblique (p2) pour M. acetivorans et de G. stearothermophilus, et leurs caractéristiques moléculaires, y compris les dimensions et la porosité, sont en bon accord avec les données des études de microscopie électronique des couches S archéennes et bactériennes.
En général, les couches S présentent une symétrie de réseau oblique (p1, p2), carrée (p4) ou hexagonale (p3, p6). Selon la symétrie du réseau, chaque unité morphologique de la couche S est composée d'une (p1), deux (p2), trois (p3), quatre (p4) ou six (p6) sous-unités protéiques identiques. L'espacement centre à centre (ou dimensions de la cellule unitaire) entre ces sous-unités varie de 4 à 35 nm[2].
Auto-assemblage
Assemblage in vivo
L'assemblage d'un réseau monomoléculaire cohérent et hautement ordonné de couches S sur une surface cellulaire en croissance nécessite la synthèse continue d'un surplus de protéines de la couche S et leur translocation vers les sites de croissance du réseau[20]. De plus, des informations concernant ce processus dynamique ont été obtenues à partir d'expériences de reconstitution avec des sous-unités isolées de la couche S sur des surfaces cellulaires dont elles avaient été retirées (rattachement homologue), ou sur celles d'autres organismes (rattachement hétérologue)[21].
Assemblage in vitro
Les protéines de la couche S ont la capacité naturelle de s'auto-assembler en réseaux monomoléculaires réguliers en solution et aux interfaces, telles que les supports solides, l'interface air-eau, les films lipidiques, les liposomes, les émulsions, les nanocapsules, les nanoparticules ou les microbilles[2] - [22]. La croissance des cristaux de la couche S suit une voie non classique dans laquelle une étape finale de repliement de la protéine de la couche S fait partie de la formation du réseau[23] - [24].
Application
Les protéines natives de la couche S ont déjà été utilisées il y a trente ans pour le développement de biocapteurs et de membranes d'ultrafiltration. Par la suite, les protéines de fusion de la couche S avec des domaines fonctionnels spécifiques (par exemple, des enzymes, des ligands, des mimotopes, des anticorps ou des antigènes) ont permis d'étudier des stratégies totalement nouvelles pour la fonctionnalisation des surfaces dans les sciences de la vie, comme le développement de nouvelles matrices d'affinité, de vaccins muqueux, de surfaces biocompatibles, de micro-porteurs et de systèmes d'encapsulation, ou dans les sciences des matériaux comme modèles pour la biominéralisation[2] - [25] - [26] - [27].
Références
- Sonja-Verena Albers et Benjamin H. Meyer, « The archaeal cell envelope », Nature Reviews. Microbiology, vol. 9, no 6, , p. 414–426 (ISSN 1740-1534, PMID 21572458, DOI 10.1038/nrmicro2576, lire en ligne, consulté le )
- Uwe B. Sleytr, Bernhard Schuster, Eva-Maria Egelseer et Dietmar Pum, « S-layers: principles and applications », FEMS microbiology reviews, vol. 38, no 5, , p. 823–864 (ISSN 1574-6976, PMID 24483139, PMCID 4232325, DOI 10.1111/1574-6976.12063, lire en ligne, consulté le )
- Thiago Rodrigues-Oliveira, Aline Belmok, Deborah Vasconcellos et Bernhard Schuster, « Archaeal S-Layers: Overview and Current State of the Art », Frontiers in Microbiology, vol. 8, , p. 2597 (ISSN 1664-302X, PMID 29312266, PMCID 5744192, DOI 10.3389/fmicb.2017.02597, lire en ligne, consulté le )
- U. B. Sleytr, P. Messner, D. Pum et M. Sára, « Crystalline bacterial cell surface layers », Molecular Microbiology, vol. 10, no 5, , p. 911–916 (ISSN 0950-382X, PMID 7934867, DOI 10.1111/j.1365-2958.1993.tb00962.x, lire en ligne, consulté le )
- U. B. Sleytr, H. Bayley, M. Sára et A. Breitwieser, « Applications of S-layers », FEMS microbiology reviews, vol. 20, nos 1-2, , p. 151–175 (ISSN 0168-6445, PMID 9276930, DOI 10.1111/j.1574-6976.1997.tb00306.x, lire en ligne, consulté le )
- U. B. Sleytr, « Self-assembly of the hexagonally and tetragonally arranged subunits of bacterial surface layers and their reattachment to cell walls », Journal of Ultrastructure Research, vol. 55, no 3, , p. 360–377 (ISSN 0022-5320, PMID 6800, DOI 10.1016/s0022-5320(76)80093-7, lire en ligne, consulté le )
- (en) Crystalline Bacterial Cell Surface Layers (DOI 10.1007/978-3-642-73537-0, lire en ligne)
- U. B. Sleytr et T. J. Beveridge, « Bacterial S-layers », Trends in Microbiology, vol. 7, no 6, , p. 253–260 (ISSN 0966-842X, PMID 10366863, DOI 10.1016/s0966-842x(99)01513-9, lire en ligne, consulté le )
- Domenica Farci, Chavdar Slavov, Enzo Tramontano et Dario Piano, « The S-layer Protein DR_2577 Binds Deinoxanthin and under Desiccation Conditions Protects against UV-Radiation in Deinococcus radiodurans », Frontiers in Microbiology, vol. 7, , p. 155 (ISSN 1664-302X, PMID 26909071, PMCID 4754619, DOI 10.3389/fmicb.2016.00155, lire en ligne, consulté le )
- Domenica Farci, Chavdar Slavov et Dario Piano, « Coexisting properties of thermostability and ultraviolet radiation resistance in the main S-layer complex of Deinococcus radiodurans », Photochemical & Photobiological Sciences: Official Journal of the European Photochemistry Association and the European Society for Photobiology, vol. 17, no 1, , p. 81–88 (ISSN 1474-9092, PMID 29218340, DOI 10.1039/c7pp00240h, lire en ligne, consulté le )
- Mario Rothbauer, Seta Küpcü, Drago Sticker et Uwe B. Sleytr, « Exploitation of S-layer anisotropy: pH-dependent nanolayer orientation for cellular micropatterning », ACS nano, vol. 7, no 9, , p. 8020–8030 (ISSN 1936-086X, PMID 24004386, DOI 10.1021/nn403198a, lire en ligne, consulté le )
- S. Schultze-Lam, G. Harauz et T. J. Beveridge, « Participation of a cyanobacterial S layer in fine-grain mineral formation », Journal of Bacteriology, vol. 174, no 24, , p. 7971–7981 (ISSN 0021-9193, PMID 1459945, DOI 10.1128/jb.174.24.7971-7981.1992, lire en ligne, consulté le )
- (en) Wayne Shenton, Dietmar Pum, Uwe B. Sleytr et Stephen Mann, « Synthesis of cadmium sulphide superlattices using self-assembled bacterial S-layers », Nature, vol. 389, no 6651, , p. 585–587 (ISSN 1476-4687, DOI 10.1038/39287, lire en ligne, consulté le )
- (en) M. Mertig, R. Kirsch, W. Pompe et H. Engelhardt, « Fabrication of highly oriented nanocluster arrays by biomolecular templating », The European Physical Journal D - Atomic, Molecular, Optical and Plasma Physics, vol. 9, no 1, , p. 45–48 (ISSN 1434-6079, DOI 10.1007/s100530050397, lire en ligne, consulté le )
- (en) Margit Sára et Uwe B. Sleytr, « Production and characteristics of ultrafiltration membranes with uniform pores from two-dimensional arrays of proteins », Journal of Membrane Science, vol. 33, no 1, , p. 27–49 (ISSN 0376-7388, DOI 10.1016/S0376-7388(00)80050-2, lire en ligne, consulté le )
- Tea Pavkov-Keller, Stefan Howorka et Walter Keller, « The structure of bacterial S-layer proteins », Progress in Molecular Biology and Translational Science, vol. 103, , p. 73–130 (ISSN 1878-0814, PMID 21999995, DOI 10.1016/B978-0-12-415906-8.00004-2, lire en ligne, consulté le )
- A. L. Houwink, « A macromolecular mono-layer in the cell wall of Spirillum spec », Biochimica Et Biophysica Acta, vol. 10, no 3, , p. 360–366 (ISSN 0006-3002, PMID 13058992, DOI 10.1016/0006-3002(53)90266-2, lire en ligne, consulté le )
- Mark A. Arbing, Sum Chan, Annie Shin et Tung Phan, « Structure of the surface layer of the methanogenic archaean Methanosarcina acetivorans », Proceedings of the National Academy of Sciences of the United States of America, vol. 109, no 29, , p. 11812–11817 (ISSN 1091-6490, PMID 22753492, PMCID 3406845, DOI 10.1073/pnas.1120595109, lire en ligne, consulté le )
- Ekaterina Baranova, Rémi Fronzes, Abel Garcia-Pino et Nani Van Gerven, « SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly », Nature, vol. 487, no 7405, , p. 119–122 (ISSN 1476-4687, PMID 22722836, DOI 10.1038/nature11155, lire en ligne, consulté le )
- Robert P. Fagan et Neil F. Fairweather, « Biogenesis and functions of bacterial S-layers », Nature Reviews. Microbiology, vol. 12, no 3, , p. 211–222 (ISSN 1740-1534, PMID 24509785, DOI 10.1038/nrmicro3213, lire en ligne, consulté le )
- U. B. Sleytr, « Heterologous reattachment of regular arrays of glycoproteins on bacterial surfaces », Nature, vol. 257, no 5525, , p. 400–402 (ISSN 0028-0836, PMID 241021, DOI 10.1038/257400a0, lire en ligne, consulté le )
- Dietmar Pum et Uwe B. Sleytr, « Reassembly of S-layer proteins », Nanotechnology, vol. 25, no 31, , p. 312001 (ISSN 1361-6528, PMID 25030207, DOI 10.1088/0957-4484/25/31/312001, lire en ligne, consulté le )
- Sungwook Chung, Seong-Ho Shin, Carolyn R. Bertozzi et James J. De Yoreo, « Self-catalyzed growth of S layers via an amorphous-to-crystalline transition limited by folding kinetics », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 38, , p. 16536–16541 (ISSN 1091-6490, PMID 20823255, PMCID 2944705, DOI 10.1073/pnas.1008280107, lire en ligne, consulté le )
- Seong-Ho Shin, Sungwook Chung, Babak Sanii et Luis R. Comolli, « Direct observation of kinetic traps associated with structural transformations leading to multiple pathways of S-layer assembly », Proceedings of the National Academy of Sciences of the United States of America, vol. 109, no 32, , p. 12968–12973 (ISSN 1091-6490, PMID 22822216, PMCID 3420203, DOI 10.1073/pnas.1201504109, lire en ligne, consulté le )
- Nicola Ilk, Eva M. Egelseer et Uwe B. Sleytr, « S-layer fusion proteins--construction principles and applications », Current Opinion in Biotechnology, vol. 22, no 6, , p. 824–831 (ISSN 1879-0429, PMID 21696943, PMCID 3271365, DOI 10.1016/j.copbio.2011.05.510, lire en ligne, consulté le )
- Bernhard Schuster et Uwe B. Sleytr, « Biomimetic interfaces based on S-layer proteins, lipid membranes and functional biomolecules », Journal of the Royal Society, Interface, vol. 11, no 96, , p. 20140232 (ISSN 1742-5662, PMID 24812051, PMCID 4032536, DOI 10.1098/rsif.2014.0232, lire en ligne, consulté le )
- Bernhard Schuster et Uwe B. Sleytr, « S-Layer Ultrafiltration Membranes », Membranes, vol. 11, no 4, , p. 275 (ISSN 2077-0375, PMID 33918014, PMCID 8068369, DOI 10.3390/membranes11040275, lire en ligne, consulté le )