Barge à queue noire
Limosa limosa

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Aves |
| Ordre | Charadriiformes |
| Famille | Scolopacidae |
| Genre | Limosa |
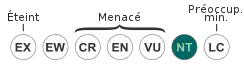
NT : Quasi menacé

La Barge à queue noire, Limosa limosa, est une espèce d'oiseaux limicoles de la famille des scolopacidés (bécassins). C'est l'une des deux espèces de barges vivant en France. Comme de nombreux limicoles c'est une espèce à longue durée de vie (plus de 17 ans parfois pour des oiseaux bagués, par exemple aux Pays-Bas[1]).
Comme la plupart des oiseaux qui s'étaient autrefois adaptés aux milieux agricoles, cette espèce a disparu d'une grande partie de son aire potentielle de répartition et est en régression, en dépit parfois des mesures agroenvironnementales mises en place pour l'aider[2]. Aux Pays-Bas, selon une étude publiée en 2008 après 20 ans de régression continue de l'espèce, ce recul semble principalement lié à une mortalité excessive des poussins, qui empêche les populations de se reconstituer, d'autres causes identifiées étant le recul des invertébrés qui sont la nourriture des poussins (déclin général et déclin aggravé dans les zones intensivement cultivées : -31 % d'invertébrés piégés en 2007 dans une zone de pâturage laitier intense, par rapport à une zone extensivement pâturée aux Pays-Bas ; « une différence assez importante pour compromettre la croissance et la survie des poussins »[3]), les changements dans la structure et la composition de la végétation et une augmentation du taux de prédation (les poussins ont besoin de hautes herbes pour leur survie et les fauchages tardifs sont rares dans leurs milieux de vie)[2]. L'espèce se montre enfin très sensible aux perturbations anthropiques (même par le simple passage de randonneurs traversant ou longeant son territoire)[4].
Description
Cet oiseau est caractérisé par un plumage brun beige, des ailes marquées d'une large barre alaire blanche et une queue de même couleur se terminant par une bande noire.
Dimorphisme sexuel : les deux sexes sont difficiles à distinguer, mais les femelles étudiées aux Pays-Bas (2008) sont plutôt plus grandes et un peu plus lourdes que les mâles ; la longueur de bec n'est pas un bon indicateur selon cette étude (contrairement à ce que la littérature laissait entendre) : la biométrie seule ne suffit pas à discriminer correctement les sexes, qui ne peuvent être identifiés que par des études biomoléculaires (ou d'imagerie médicale). Les barges à queue noire sont cependant dimorphes pour la quantité de points blancs sur le cou, les femelles étant également plus claire que les mâles, et ornées de moins de barres noires et moins de couleur orange sur la poitrine, avec plus de blanc sur la tête et moins de plumes de reproduction dans le dos.
Un polymorphisme génotypique sur le gène CHD1 lié au sexe sur le chromosome Z fréquemment utilisé pour le sexage moléculaire d'oiseaux. Chez les mâles du génotype plus rare, il y a plus de blanc dans le plumage et moins de barres noires sur leur poitrine, contre aucune différence détectée chez les femelles entre les deux génotypes[5].
Habitat
En période de nidification, la barge à queue noire s'installe dans les prés surtout humides. Lors des migrations et en hivernage, elle fréquente des milieux variés : marais, lagunes, estuaires et bassins de décantation.
En France, son premier site d'hivernage est la baie de l'Aiguillon en Charente-Maritime qui à lui seul rassemble de 30 à 50 % des effectifs hivernant en France, ce qui peut représenter jusqu'à 5 400 individus[6].
Comportement, nidification
Cette espèce effectue des migrations à grande distance, mais se montre très fidèle à ses sites de reproduction qu'elle cherchera à regagner chaque année. Le nid est fait dans des creux au sol dans la végétation dense (3-4 œufs /1 ponte /mai-juin).
Alimentation
La barge à queue noire est un prédateur d'invertébrés, en particulier d'annélides. Son alimentation varie beaucoup selon son âge et les milieux qu'elle occupe (des prairies aux vasières d'estuaires). Les mâles adultes qui au moment de la reproduction mangent principalement des vers de terre (connus pour bioaccumuler des métaux lourds et certains autres polluants du sol, ce qui peut affecter les chances de survie des individus qui les consomment[7])[1]. Les adultes en hiver étudiés dans l'estuaire du Tage (Portugal) consommaient essentiellement le bivalve Scrobicularia plana (88 % de la biomasse ingérée), les 12 % restants étaient surtout le ver marin Hediste diversicolor (de toutes tailles, du moment que le ver mesure plus de 2 cm, prélevés dans le sédiment quand la marée le découvre, où l'oiseau risque aussi de trouver des plombs de chasse). L'escargot Hydrobia ulvae est une autre proie, mais moins fréquente. Le régime alimentaire varie au cours de l'hiver en s'adaptant à la disponibilité des proies (Néréididés et petits bivalves Scrobicularia). Durant l'alimentation chaque oiseau de l'estuaire ingérait en moyenne 74,9 mg de poids sec par minute, soit un apport énergétique net de 1,21 kJ/minute[8].
Prédation
Comme tous les oiseaux pondant leurs œufs sur le sol, la barge à queue noire a de nombreux prédateurs : plus d'une vingtaine selon une étude néerlandaise (2008), essentiellement sur les œufs (plutôt prélevés par des mammifères la nuit) et les poussins (plutôt prélevés par d'autres oiseaux)[9].
État des populations, menaces
_in_flight.jpg.webp)
Comme tous les limicoles et de nombreux oiseaux d'eau, cette espèce souffre du recul et de la fragmentation et dégradation des zones humides (prairies humides en particulier[1]) ainsi parfois que de leur pollution (chronique ou accidentelle comme avec la catastrophe de Donana (déversement de 5 millions de mètres cubes de déchets acides issus du traitement du minerai de pyrite dans une zone humide d'importance européenne pour les oiseaux migrateurs[10] ; de par son mode d'alimentation, dans les bordures de zones humides chassées ou autrefois chassées ou exposées aux retombées de tir de ball-trap, elle peut directement absorber des grenaille de plomb de chasse[11] et alors mourir de saturnisme aviaire ou tomber malade ou être plus facilement tuée par collision avec un véhicule, une ligne électrique, ou être victime de prédation à cause d'un empoisonnement par le plomb (et par l'arsenic et l'antimoine qui sont associés au plomb dans les munitions de chasse) qui rend l'animal plus vulnérable à ces autres sources de mortalité. De plus sa position dans le réseau trophique fait qu'en consommant les invertébrés des sédiments qui ont pu bioaccumuler divers toxiques (résidus de pesticides, métaux lourds, métalloïdes toxiques...) elle est aussi exposée à l'ingestion et à la bioaccumulation de diverses toxines, d'autant qu'elle se nourrit facilement sur les bassins ou anciens bassins de décantation de stations d'épuration industrielles[1].
En 2008, une étude faite aux Pays-Bas (où l'espèce est sur liste rouge, car en déclin fort et régulier depuis les années 1960, avec semble-t-il une aggravation de la mortalité vers 1990[12]) a mesuré les taux de métaux lourds du sol, des vers de terre (3 espèces : Allolobophora chlorotica, Aporrectodea caliginosa et Lumbricus rubellus) et des œufs (67 œufs provenant de 35 nids différents) et des plumes de barges à queue noire se reproduisant dans des prairies humides polluées par des métaux (en les comparant à ceux mesurés dans des prairies non polluées). Le plomb, le mercure et le cadmium sont effectivement transférés du sol vers l'organisme des barges « bien que l’espèce ne passe que quelques mois dans la zone de reproduction au cours de l’année »[1]. Ceci peut affecter la fitness de l'espèce (c'est-à-dire la capacité de survie des individus dans leur environnement)[1]. L'espèce tente, au Portugal par exemple, d'utiliser les rizières qui ont remplacé ses habitats naturels sur une partie de son aire de répartition[13] ; une gestion plus écologique des rizières pourrait être selon une étude[14] nécessaire pour garantir la disponibilité de haltes migratoires et d'habitats de meilleure qualité. Ceci pourrait être fait en encourageant l'agriculture biologique, mais aussi par un gestion plus attentive du niveau d'eau et des cultures. Des analyses d'excréments de barges ont permis d'identifier les invertébrés consommés dans les rizières par ces oiseaux[14] ; et l'abondance de ces aliments a pu être mesurée in situ afin de mieux comprendre les choix d'habitats fait par l'oiseau ; ce travail a montré que les rizières inondées et labourées ont les plus fortes densités de grains de riz enfouis, qui semblent ici être la principale source de nourriture pour les barges à queue noire[14]. Une modification de la riziculture avec labour tardif ainsi que la diminution prévue de la pluviométrie estivale risquent d'entraîner une nouvelle perte d'habitats de substitution pour cette espèce[14].
Enfin, alors que l'espèce a perdu en Europe au moins la moitié de ses habitats en 30 ans, il a été montré (en 2009) que le dérangement (par la chasse et par d'autres activités y compris de simples passages répétés de randonneurs) affecte le succès de reproduction et la survie des individus)[4] : une étude expérimentale contrôlée faite dans une ZPS (zone de protection spéciale de Tipperne a montré que cette espèce est « très sensible aux perturbations humaines et peu encline à s'y habituer »[4]. La perturbation induite seulement par le passage de sept marcheurs/jour a affecté les densités de présence jusqu'à 500 m des chemins empruntées par les marcheurs, causant l'équivalent d'une perte très importante d'habitat efficace pour l'espèce[4]. L'espèce décline aussi à proximité des routes, plus que d'autres selon une étude de 1996 faite aux Pays-Bas[15].
Taxinomie et génétique
Certains auteurs ont pensé qu'il s'agissait de la même espèce que la barge hudsonienne (Limosa haemastica) mais une étude de leur ADN mitochondrial respectif a montré une divergence de 5 %, confirmant le statut d'espèces distinctes[16].
Selon Alan P. Peterson cette espèce est constituée (sur la base des différences morphologiques) des trois sous-espèces suivantes :
- Limosa limosa islandica C.L. Brehm 1831 ;
- Limosa limosa limosa (Linnaeus) 1758 ;
- Limosa limosa melanuroides Gould 1846.
Ces 3 sous-espèces sont faiblement différenciées du point de vue de leur ADN mitochondrial (0,3-0,6 % de différences pour l'ADN mitochondrial testé), mais cet ADN mitochndrial ne montre pas de signes de flux génétique substantiel entre ces sous-espèces (haplotypes propres à chaque sous-espèce).
Au sein de la métapopulation présente en Europe de l'Ouest, des différences génétiques significatives ont été trouvées selon les zones géographiques avec des indices d'« effet fondateur » pour les petites populations marginales par rapport aux grandes populations plus homogènes.
D'après la classification de référence (version 12.2, 2022) du Congrès ornithologique international (ordre phylogénique), cette espèce est constituée des quatre sous-espèces suivantes :
- Limosa limosa islandica Brehm, CL, 1831 — Islande, îles Féroé, Shetland et nord de la Norvège ;
- Limosa limosa limosa (Linnaeus, 1758) — de l'ouest et du centre de l'Europe jusqu'au centre de l'Asie ;
- Limosa limosa melanuroides Gould, 1846 — centre et est de l'Asie ;
- Limosa limosa bohaii Zhu, Verkuil, Conklin, Yang A, Lei W, Alves, Hassell, Dorofeev, Zhang Z, Piersma, 2020 — Extrême-Orient russe (présumé).
Répartition
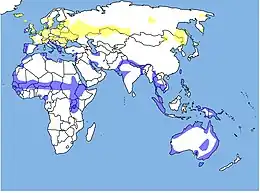
- habitat permanent
- zone d'hivernage
- nidification
Voir aussi
Liens externes
- (fr) Référence Oiseaux.net : Limosa limosa (+ répartition)
- (en) Référence Congrès ornithologique international : (consulté le )
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Limosa limosa dans Charadriiformes
- (fr+en) Référence Avibase : Limosa limosa (Linnaeus, 1758) (+ répartition) (consulté le )
- (en) Référence Fauna Europaea : Limosa limosa(Linnaeus, 1758) (consulté le )
- (en) Référence Animal Diversity Web : Limosa limosa
- (en) Référence NCBI : Limosa limosa (taxons inclus)
- (en) Référence UICN : espèce Limosa limosa (consulté le )
- ONCFS: Plan national de gestion(2015-2020) Barge à queue noire
Bibliographie
- Beintema A.J & Drost N (1986) Migration of the black-tailed godwit. Gerfaut 76: 37–62
- Bocher P, Frédéric Robin, Bernard Deceuninck & Emmanuel Caillot (2013) Distribution, Phenology and Long-Term Population Trends in Blacktailed Godwits Limosa Limosa wintering in Coastal France. Acta Ornithologica 48:2, 141-150. Online publication date: 24-Feb-2014.
- Lourenço P.M & Piersma T (2008) Stopover ecology of Black-tailed Godwits Limosa limosa limosa in Portuguese rice fields: a guide on where to feed in winter. Bird study, 55(2), 194-202 (résumé)
- Lourenço P.M, Kentie R, Schroeder J, Alves J.A, Groen N.M, Hooijmeijer J.C & Piersma T (2010). Phenology, stopover dynamics and population size of migrating Black-tailed Godwits Limosa limosa limosa in Portuguese rice plantations. Ardea, 98(1), 35-42.
- Moreira F (1994) Diet, prey‐size selection and intake rates of Black‐tailed Godwits Limosa limosa feeding on mudflats. Ibis, 136(3), 349-355 (résumé).
- Lopes R.J & al. (2013) Do different subspecies of Black-tailed Godwit Limosa limosa overlap in Iberian wintering and staging areas? Validation with genetic markers. Journal of Ornithology 154:1, 35-40. Mis en ligne le 21 Juin 2012.
- Lourenço PM, Rosemarie Kentie, Julia Schroeder, Niko M. Groen, Jos C. E. W. Hooijmeijer, Theunis Piersma. (2011) Repeatable timing of northward departure, arrival and breeding in Black-tailed Godwits Limosa l. limosa, but no domino effects. Journal of Ornithology 152:4, 1023-1032. Mis en ligne le 27 avril 2011.
- Roodbergen M & Klok C (2008) Timing of breeding and reproductive output in two Black-tailed Godwit Limosa limosa populations in The Netherlands. Ardea, 96(2), 219-232.
- Schekkerman H, Teunissen W & Oosterveld E (2008) The effect of ‘mosaic management’on the demography of black‐tailed godwit Limosa limosa on farmland. Journal of Applied Ecology, 45(4), 1067-1075
- Schekkerman, H., & Beintema, A. J. (2007). Abundance of invertebrates and foraging success of Black-tailed Godwit Limosa limosa chicks in relation to agricultural grassland management. Ardea, 95(1), 39-54
- Teunissen W, Schekkerman H, Willems F & Majoor F (2008) Identifying predators of eggs and chicks of Lapwing Vanellus vanellus and Black‐tailed Godwit Limosa limosa in the Netherlands and the importance of predation on wader reproductive output. Ibis, 150, 74-85
- Melman T.C, Schotman A.G.M, Hunink S. & De Snoo G.R (2008) Evaluation of meadow bird management, especially black-tailed godwit (Limosa limosa L.), in the Netherlands. Journal for Nature Conservation, 16(2), 88-95 (résumé)
- Piersma T (1997) Do global patterns of habitat use and migration strategies co-evolve with relative investments in immunocompetence due to spatial variation in parasite pressure ?. Oikos, 623-631 (résumé).
Notes et références
- Roodbergen M, Klok C & van der Hout A (2008) Transfer of heavy metals in the food chain earthworm Black-tailed godwit (Limosa limosa): comparison of a polluted and a reference site in The Netherlands. Science of the total environment, 406(3), 407-412.
- Schekkerman H, Teunissen W & Oosterveld E (2008) The effect of ‘mosaic management’on the demography of black‐tailed godwit Limosa limosa on farmland. Journal of Applied Ecology, 45(4), 1067-1075
- Schekkerman H & Beintema A.J (2007) Abundance of invertebrates and foraging success of Black-tailed Godwit Limosa limosa chicks in relation to agricultural grassland management. Ardea, 95(1), 39-54.
- Holm, T. E., & Laursen, K. (2009). Experimental disturbance by walkers affects behaviour and territory density of nesting Black‐tailed Godwit Limosa limosa. Ibis, 151(1), 77-87. (résumé)
- Schroeder J, Lourenço P.M, Velde M.V.D, Hooijmeijer J.C, Both C & Piersma T (2008) Sexual dimorphism in plumage and size in Black-tailed Godwits Limosa limosa limosa. Ardea, 96(1), 25-37
- Anne-Lise Durif, « La barge en baie libre », Le Mag no 436, supplément à Sud Ouest, , p. 26-27.
- Klok C, van der Hout A & Bodt J (2006) Population growth and development of the earthworm Lumbricus rubellus in a polluted field soil: Possible consequences for the godwit (Limosa limosa). Environmental toxicology and chemistry, 25(1), 213-219 (résumé).
- Moreira F (1994) Diet, prey‐size selection and intake rates of Black‐tailed Godwits Limosa limosa feeding on mudflats. Ibis, 136(3), 349-355 (résumé)
- Teunissen W, Schekkerman H, Willems F & Majoor F (2008) Identifying predators of eggs and chicks of Lapwing Vanellus vanellus and Black‐tailed Godwit Limosa limosa in the Netherlands and the importance of predation on wader reproductive output. Ibis, 150, 74-85
- Pain D.J, Sanchez A & Meharg A.A (1998) The Donana ecological disaster: contamination of a world heritage estuarine marsh ecosystem with acidified pyrite mine waste. Science of the Total Environment, 222(1-2), 45-54. (résumé), déchets qui ont fait chuter le pH du marais de 8,5 à 4,5 en y apportant de l'arsenic (0,6% des déchets en poids sec), du plomb (1,2%) et du zinc (0,8%).
- Pain D.J (1990) Lead shot ingestion by waterbirds in the Camargue, France: an investigation of levels and interspecific differences. Environmental Pollution, 66(3), 273-285 (résumé)
- van Noordwijk, A. J., & Thomson, D. L. (2008). Survival rates of Black-tailed Godwits Limosa limosa breeding in The Netherlands estimated from ring recoveries. Ardea, 96(1), 47-57.
- Masero J.A, Santiago-Quesada F, Sanchez-Guzman J.M, Villegas A, Abad-Gomez J.M, Lopes R.J,... & Moran R (2011) Long lengths of stay, large numbers, and trends of the Black-tailed Godwit Limosa limosa in rice fields during spring migration. Bird Conservation International, 21(1), 12-24.
- Lourenço P.M & Piersma T (2008) Stopover ecology of Black-tailed Godwits Limosa limosa limosa in Portuguese rice fields: a guide on where to feed in winter. Bird study, 55(2), 194-202 (résumé).
- Reijnen, R., Foppen, R., & Meeuwsen, H. (1996). The effects of traffic on the density of breeding birds in Dutch agricultural grasslands. Biological conservation, 75(3), 255-260.
- Höglund J, Johansson T, Beintema A & Schekkerman H (2009) Phylogeography of the Black-tailed Godwit Limosa limosa: substructuring revealed by mtDNA control region sequences. Journal of Ornithology, 150(1), 45-53.