Aiguillat noir
Centroscyllium fabricii

- Spinax fabricii Reinhardt, 1825

LC [1] : Préoccupation mineure
L'Aiguillat noir (Centroscyllium fabricii) est une espèce de requins de la famille des Etmopteridae. Il est commun dans la zone externe du plateau continental et du talus continental à une profondeur allant de 180 à 2 250 m. Les femelles vivent généralement dans des eaux plus profondes que les mâles, et en fonction de la région, les jeunes requins peuvent fréquenter une profondeur différente de celle des adultes. Cette espèce est largement répandue dans l'océan Atlantique, du Groenland à l'Islande et de la Virginie jusqu'au nord de l'Afrique de l'Ouest, le sud-ouest et l'Afrique et au sud de l'Argentine. L'aiguillat noir mesure en moyenne 60 à 75 cm de longueur, ce qui en fait le plus grand membre de sa famille. Il a un corps massif brun sombre, qui est plus foncé en bas qu'en haut et porte des organes bioluminescents. Ses deux nageoires dorsales sont précédées par de grosses épines, et la nageoire anale est absente.
Se déplaçant en banc, l'aiguillat noir est un prédateur opportuniste qui consomme essentiellement des poissons osseux, des crustacés et des céphalopodes. Il est vivipare aplacentaire ; les femelles mettent au monde des portées de 4 à 40 juvéniles alimentées à terme par un sac vitellin. Il n'y a pas de saison de reproduction bien définie. L'aiguillat noir est une prise accidentelle de la pêche commerciale en haute mer opérant dans l'Atlantique Nord ; il est de faible valeur commerciale et est habituellement mis au rebut. Comme une grande partie de son habitat se situe en eau profonde et que sa population au nord-ouest de l'Atlantique semble être stable, l'Union internationale pour la conservation de la nature (UICN) a classé cette espèce dans la catégorie « préoccupation mineure ». Il est cependant classé dans la catégorie « quasi menacé » dans le nord de l'Atlantique, où la population a diminué notamment à cause de la surpêche.
Description
.jpg.webp)
L'aiguillat noir adulte mesure généralement entre 60 et 75 cm de long et peut atteindre jusque 1,1 m, ce qui en fait le plus grand membre de la famille des Etmopteridés[2] - [3]. Un mâle de 60 cm pèse près d'un kilogramme, les plus gros atteignent 80 cm pour 2,3 kg[4]. La femelle atteint une taille supérieure à celle du mâle, et les plus grosses pèsent jusqu'à 4 kg pour une longueur de 90 cm[4]. Ce requin a un corps plutôt trapu et comprimé latéralement, avec un museau modérément long, épais et aplati qui forme un arc très large à l'avant. Les yeux, grands et ovales, sont verts, réfléchissants, et ne possèdent pas de membranes nictitantes (troisième paupière) ; ils sont suivis par des stigmates beaucoup plus petits (ouvertures accessoires pour la respiration). Les narines sont placées vers l'avant et précédées par de petits rabats de peau. La gueule est large et uniformément arquée, avec des lèvres minces et courtes, mais des sillons profonds dans les coins. Il possède environ 34 rangées de dents sur les deux côtés des deux mâchoires. Chaque dent a trois (parfois cinq) cuspides élancées, avec la centrale plus longue[3] - [5] - [6].
Les deux nageoires dorsales sont précédées par deux grosses épines blanches rainurées, avec la seconde beaucoup plus longue que la première. La première nageoire dorsale a un sommet arrondi et une marge arrière presque droite, qui part de l'arrière des nageoires pectorales. La deuxième nageoire dorsale est plutôt anguleuse et a environ le double de la superficie de la première, avec son origine située au milieu de la base de la nageoire pelvienne. Les nageoires pectorales sont petites et arrondies. Les nageoires pelviennes sont à peu près aussi grande que la deuxième nageoire dorsale, aux extrémités arrondies et presque rectilignes à l'arrière. Le pédoncule caudal est court et mène à une nageoire caudale large comprenant au moins un quart de la longueur totale ; le lobe supérieur a une marge supérieure convexe conduisant à une pointe carrée, tandis que le lobe inférieur est indistinct. La peau est densément couverte par de minuscules denticules dermiques ; chacun a une base en forme d'étoile irrégulière, et recourbé en épine. Cette espèce est brun foncé sur la face dorsale et presque noir sur la face ventrale, et les épines de la nageoire dorsale sont blanches. Les juvéniles ont des bords blancs sur la nageoire dorsale, les nageoires pectorales et les pelviennes. Sa peau est parsemée de petits points bioluminescents sans former un schéma régulier[3] - [5] - [6].
Distribution et habitat
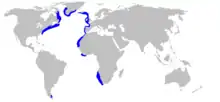
L'aiguillat noir est une espèce commune avec une large distribution, non continue, dans les eaux tempérées de l'océan Atlantique, qui jouxte, sans s'y étendre, l'océan Arctique. Dans le nord, il vit de l'Islande à la Sierra Leone, y compris les îles Féroé, le sud de la Norvège, le fossé de Rockall et la baie de Porcupine, au large de l'Irlande. Dans le nord-ouest, on le trouve du sud du Groenland et de l'île de Baffin à la Virginie, étant particulièrement abondant dans le chenal Laurentien, et peut se trouver plus au sud dans le Golfe du Mexique au large de l'Alabama[1] - [5]. Dans le sud, on le trouve au large de la Namibie et de l'Afrique du Sud jusqu'au cap des Aiguilles. Dans le sud-ouest, il a été observé à partir du canal Beagle, à l'extrémité sud de l'Argentine[7].
L'aiguillat noir vit sur le plateau continental et le talus continental. Il se trouve surtout près du fond entre 180 et 2 250 m de profondeur[5]. Il est plus fréquent à des profondeurs de 800 à 1 200 m au large de l'Islande, 1 250 à 1 500 m dans la fosse de Rockall, de 500 à 1 300 m au large du Groenland, de 350 à 500 m au large du nord du Canada, et en dessous de 500 m au large de l'Afrique australe[1] - [4]. Cette espèce peut s'aventurer près de la surface à l'extrême nord de son aire, en particulier pendant la nuit, durant les mois d'hiver[5]. La ségrégation sexuelle a été documentée dans l'Atlantique Nord, avec des femelles plus nombreuses que les mâles à des profondeurs supérieures à 1 000 m. La ségrégation par taille varie selon la région : les grands individus se trouvent généralement dans les eaux profondes au large de l'ouest du Groenland, dans les eaux peu profondes à l'ouest de l'Islande, et sans motif par rapport à la profondeur hors orientale Islande[4]. L'aiguillat noir préfère les températures basses de 3,5-4,5 °C, bien qu'au large du nord du Canada, il est plus abondant dans l'eau de 5 à 6,5 °C ; il peut supporter des températures allant jusqu'à 1 °C[1]. Cette espèce effectue des migrations saisonnières : il passe l'hiver et le printemps dans les eaux peu profondes[5]. Les individus au large du nord du Canada effectuent des mouvements liés au développement (voir ci-dessous) qui ne sont pas observés au large du Groenland occidental, suggérant la présence de deux populations distinctes dans le nord-ouest de l'Atlantique[1].
Écologie et comportement
L'aiguillat noir vit en bancs qui ont tendance à être plus grands durant l'hiver et le printemps[5] - [8]. Bien que relativement actif, ses muscles présentent une activité inférieure des enzymes de la glycolyse et une plus grande activité de la créatine phosphokinase par rapport à l'Aiguillat commun, suggérant une moindre capacité de vitesse[9]. Le foie est riche en lipides avec environ un cinquième du poids total et permet une flottabilité neutre. Les prédateurs potentiels de l'Aiguillat noir sont les grands requins et les grands poissons osseux[3]. C'est l'un des nombreux requins des grands fonds parasités par la bernacle Anelasma squalicola, qui s'attache à l'avant de la deuxième nageoire dorsale et empêche parfois la reproduction de son hôte[10]. Les autres parasites connus de cette espèce comprennent le trématode Otodistomum cestoides[11], les copépodes Neoalbionella fabricii et Neoalbionella centroscyllii[12] - [13] et les protozoaires Haemogregarina delagei et Trypanosoma rajae[14].
Régime alimentaire

Apparemment opportuniste dans ses habitudes alimentaires, l'aiguillat noir chasse généralement en pleine eau, mais aussi près du fond[15] - [16]. L'essentiel de son régime alimentaire se compose de divers poissons osseux, notamment les grenadiers, les merlans, les rascasses, les poissons-lanternes et les lussions, ainsi que les crustacés pélagiques tels que le krill, les crevettes et les petits céphalopodes. La part de poissons devient plus importante au fur et à mesure que le requin vieillit, tandis que celle des crustacés diminue. Parfois, il consomme des vers polychètes et des méduses[4] - [16]. Dans l'Atlantique nord-ouest, les abats de flétans du Groenland et de grenadiers jetés des bateaux de pêche sont devenus une source importante de nourriture pour cette espèce, en particulier pour les individus âgés qui sont capables de consommer les plus gros morceaux tels que la tête[17].
Cycle de vie
La reproduction chez l'aiguillat noir a lieu toute l'année, sans plan saisonnier[4] - [18]. Cette espèce est ovovivipare, les embryons en développement sont retenus à l'intérieur de l'utérus et sont soutenus à terme uniquement par leur sac vitellin. Les femelles matures ont deux ovaires et deux utérus fonctionnels. Les œufs fertilisés sont ovulés dans l'utérus à un diamètre de 3,0 à 4,5 cm ; bien que quelques-uns peuvent être conservés dans les ovaires, les œufs ne sont pas enfermés dans une capsule. Le sac vitellin est complètement résorbé lorsque l'embryon est arrivé à long terme, hormis le jaune ayant été transféré à un sac vitellin interne attaché à l'intestin. Le sac vitellin interne alimente le nouveau-né jusqu'à ce qu'il apprenne à se nourrir. La portée compte de 4 à 40 individus, avec une moyenne à 16,4[18]. Les nouveau-nés mesurent entre 13 et 19 cm de long[18] - [19].
Divers auteurs ont rapporté une taille à maturité allant de 46 à 63 cm pour les mâles et de 51 à 70 cm pour les femelles, reflétant les différences entre zones géographiques[1]. Hors du nord du Canada, les femelles donnent naissance dans la partie du chenal Laurentien à moins de 400 m de profondeur. En grandissant, les jeunes migrent vers les parties plus profondes de la Manche, et finalement vers le nord, sur les Grands Bancs et le plateau du Labrador, dans la partie profonde du talus continental. Ce modèle de mouvement n'a pas été observé chez les individus vivant dans les eaux adjacentes au large ouest du Groenland. Un certain nombre de spécimens anormaux hermaphrodites ont été documentés[18].
Taxinomie et phylogénie

Le premier spécimen connu d'aiguillat noir a été recueilli près de Julianehåb au Groenland et décrit par le zoologiste danois Johan Reinhardt dans son Bidrag Ichthyologiske publié en 1838[20]. Reinhardt lui donna le nom de Spinax fabricii en l'honneur du missionnaire et naturaliste Otto Fabricius, pionnier de l'étude des poissons du Groenland. Les biologistes allemands Johannes Müller et Henle Jakob, dans leur Plagiostomen Systematische der Beschreibung, ont créé le nouveau genre Centroscyllium pour cette espèce[21] - [22]. L'espèce est placée parmi les etmopteridés, parfois placée parmi les dalatiidés en tant que sous-famille.
Selon l'UICN, d'autres recherches taxinomiques sont nécessaires pour confirmer que l'aiguillat noir dans l'Atlantique Nord et celui du sud-est de l'Atlantique sont de la même espèce[1]. En 2010, une étude phylogénétique menée par Nicolas Straube et ses collègues, basée sur l'ADN nucléaire et mitochondrial, a constaté que l'aiguillat noir est l'espèce sœur de l'aiguillat à nageoires blanches (C. ritteri) et que les deux sont issus du clade formé par l'aiguillat râpe (C. granulatum) et l'aiguillat peigne (C. nigrum)[2].
Relations avec l'homme
L'aiguillat noir est inoffensif pour l'homme et de faible valeur commerciale. Un nombre important est capturé accidentellement par les hauturières commerciales au chalut, au filet maillant et à la pêche à la palangre dans l'Atlantique Nord, comme la pêche islandaise du flétan du Groenland, la pêche au chalut française d'espèces mixtes et les pêcheries canadiennes du Flétan du Groenland, de crabes, de sébaste, de baudroies et de fausse-limandes. Les requins capturés sont habituellement mis au rebut, mais ces dernières années, l'Aiguillat noir et d'autres petits requins d'eaux profondes ont été de plus en plus conservés et utilisés pour faire de la farine de poisson[1] - [3]. Les prises rapportées par les pays européens, dont la France a le plus contribué, ont suivi une tendance à la baisse de 486 tonnes en 2001 à 35 tonnes en 2006[23]. La moyenne des captures par les pêcheries du Canada était de 68 tonnes par an de 1996 à 2005. L'aiguillat noir vit trop en profondeur pour la pêche au large de l'Afrique australe ; dans le reste de sa répartition, il y a peu d'informations disponibles sur l'impact de la pêche[1].
L'Union internationale pour la conservation de la nature (UICN) a inscrit l'aiguillat noir sous préoccupation mineure dans le monde entier. Il est peu affecté par l'activité de la pêche dans de nombreuses régions de son aire de répartition, alors que sa population dans l'Atlantique nord-ouest semble actuellement être stable et peut avoir augmenté entre 1978 à 1995[1] - [24]. En revanche, l'intensité de la pêche en eaux profondes dans l'Atlantique nord a conduit l'UICN à lui donner une évaluation régionale d'espèce quasi menacée. Les caractéristiques de reproduction de l'aiguillat noir, comme une taille de maturation élevée chez la femelle, peut le rendre vulnérable à la surpêche, mais il s'avère être plus fécond que d'autres requins des profondeurs. Dans l'Atlantique nord-ouest, des captures de cette espèce sont gérées dans le cadre du total autorisé de capture (TAC) pour les requins, fixé par le Conseil international pour l'exploration de la mer (CIEM)[1].
Voir aussi
Articles connexes
Références taxinomiques
- (en) Référence Catalogue of Life : Centroscyllium fabricii (Reinhardt, 1825) (consulté le )
- (fr+en) Référence FishBase :
- (fr) Référence INPN : Centroscyllium fabricii (Reinhardt, 1825) (TAXREF)
- (fr+en) Référence ITIS : Centroscyllium fabricii (Reinhardt, 1825)
- (en) Référence World Register of Marine Species : espèce Centroscyllium fabricii (Reinhardt, 1825)
- (en) Référence Animal Diversity Web : Centroscyllium fabricii
- (en) Référence NCBI : Centroscyllium fabricii (taxons inclus)
- (en) Référence UICN : espèce Centroscyllium fabricii (consulté le )
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Black dogfish » (voir la liste des auteurs).
- UICN, consulté le 22 juillet 2011
- (en) N. Straube, S.P. Iglésias, D.Y. Sellos, J. Kriwet et U.K. Schliewen, « Molecular phylogeny and node time estimation of bioluminescent Lantern Sharks (Elasmobranchii: Etmopteridae) », Molecular Phylogenetics and Evolution, vol. 56, no 3, , p. 905–917 (PMID 20457263, DOI 10.1016/j.ympev.2010.04.042, lire en ligne)
- (en) George Burgess et Cathy Bester, « Biological Profiles: Black Dogfish », Florida Museum of Natural History Ichthyology Department. (consulté le )
- (en) K.B. Jakobsdóttir, « Biological aspects of two deep-water squalid sharks: Centroscyllium fabricii (Reinhardt, 1825) and Etmopterus princeps (Collett, 1904) in Icelandic waters », Fisheries Research, vol. 51, nos 2–3, , p. 247–265 (DOI 10.1016/S0165-7836(01)00250-8, lire en ligne)
- (en) Leonard J.V. Compagno, Sharks of the World: An Annotated and Illustrated Catalogue of Shark Species Known to Date, Food and Agricultural Organization, (ISBN 9251013845), p. 46–48
- (en) H.B. Bigelow et W.C. Schroeder, Fishes of the Western North Atlantic, Part 1, Sears Foundation for Marine Research, Yale University, , p. 480–486
- (en) R.C. Menni, G.H. Burgess et M.L. Garcia, « Occurrence of Centroscyllium fabricii (Reinhardt, 1825)(Elasmobranchii, Squalidae) in the Beagle Channel, southern south America », Bulletin of Marine Science, vol. 52, no 2, , p. 824–832 (lire en ligne)
- (en) F. Uiblein, M. Youngbluth, C. Jacoby, F. Pages, M. Picheral et G. Gorsky, Deep Sea 2003: Conference on the Governance and Management of Deep-sea Fisheries, Queenstown (New Zealand), 1–5 Dec 2003, Food and Agricultural Organization of the United Nations, (ISBN 9251054029), « In situ observations of deepwater fishes in four canyons off the Georges Bank, NW Atlantic », p. 98–106
- (en) J.R. Treberg, R.A. Martin et W.R. Driedzic, « Muscle enzyme activities in a deep-sea squaloid shark, Centroscyllium fabricii, compared with its shallow-living relative, Squalus acanthias », Journal of Experimental Zoology Part A: Comparative Experimental Biology, vol. 300A, no 2, , p. 133–139 (DOI 10.1002/jez.a.10318, lire en ligne)
- (en) K. Yano et J.A. Musick, « The Effect of the Mesoparasitic Barnacle Anelasma on the Development of Reproductive Organs of Deep-sea Squaloid Sharks, Centroscyllium and Etmopterus », Environmental Biology of Fishes, vol. 59, no 3, , p. 329–339 (DOI 10.1023/A:1007649227422, lire en ligne)
- (en) D.I. Gibson, Guide to the Parasites of Fishes of Canada, vol. 4, NRC Research Press, (ISBN 0660164035), p. 74
- (en) L.A. Rubec et W.E. Hogans, « Albionella fabricii n. sp. (Copepoda: Lernaeopodidae) from the gills of Centroscyllium fabricii from the Northwest Atlantic », Systematic Parasitology, vol. 11, no 3, , p. 219–225 (DOI 10.1007/BF00010002, lire en ligne)
- (en) S.M. Rodríguez, J.L. Luque et M. George-Nascimento, « A parasitic copepod, Neoalbionella sp. (Lernaeopodidae), on the southern lanternshark Etmopterus granulosus (Etmopteridae) off Juan Fernández Archipelago, Chile », Revista de Biología Marina y Oceanografía, vol. 45, no 2, , p. 359–363 (DOI 10.4067/S0718-19572010000200020, lire en ligne, consulté le )
- (en) T.E. McDonald et L. Margolis, Synopsis of the parasites of fishes of Canada: Supplement (1978–1993), NRC Research Press, (ISBN 0660159023), p. 9, 19
- (en) G.R. Sedberry et J.A. Musick, « Feeding strategies of some demersal fishes of the continental slope and rise off the Mid-Atlantic Coast of the USA », Marine Biology, vol. 44, no 4, , p. 357–375 (DOI 10.1007/BF00390900, lire en ligne)
- (en) J. Mauchline et J.D.M. Gordon, « Diets of the sharks and chimaeroids of the Rockall Trough, northeastern Atlantic Ocean », Marine Biology, vol. 75, nos 2–3, , p. 269–278 (DOI 10.1007/BF00406012, lire en ligne)
- (en) A. Punzón et M.A. Herrera, « Feeding of Centroscyllium fabricii and the influence of discards on its diet in Flemish Pass (north-west Atlantic) », Journal of the Marine Biological Association of the UK, vol. 80, no 4, , p. 755–756 (DOI 10.1017/S002531540000268X, lire en ligne)
- (en) K. Yano, « Reproductive Biology of the Black Dogfish, Centroscyllium Fabricii, Collected From Waters off Western Greenland », Journal of the Marine Biological Association of the United Kingdom, vol. 75, no 02, , p. 285–310 (DOI 10.1017/S002531540001818X, lire en ligne)
- (en) R.L. Haedrich et A.G. Hopper (rédacteur), Deep-water Fisheries of the North Atlantic Oceanic Slope, Kluwer Academic Éditeurs, (ISBN 0792335112), « Structure over time of an exploited deepwater fish assemblage », p. 70–96
- (da) Johan Reinhardt, Icthyologiske bidrag til den grönlandske fauna, Kiöbenhavn, (lire en ligne)
- (en) Johannes Müller et Jakob Henle, Systematische Beschreibung der Plagiostomen, Berlin, Veit und comp., , 191 p. (lire en ligne)
- (en) B.W. Evermann et D.S. Jordan, « The Fishes of North and Middle America: A Descriptive Catalogue of the Species of Fish-like Vertebrates Found in the Waters of North America, North of the Isthmus of Panama (Volume 1) », Government Printing Office, , p. 56
- (en) « Report of the Working Group Elasmobranch Fishes (WGEF) », ICES (International Council for the Exploration of the Sea, (consulté le )
- (en) K.D. Baker, J.A. Devine et R.L. Haedrich, « Deep-sea fishes in Canada’s Atlantic: population declines and predicted recovery times », Environmental Biology of Fishes, vol. 85, no 1, , p. 79–88 (DOI 10.1007/s10641-009-9465-8, lire en ligne)