Acide 3-nitrobenzoïque
L'acide 3-nitrobenzoïque est un composé aromatique de formule C6H4(NO2)CO2H. Constitué d'un cycle benzénique substitué par un groupe nitro (NO2) et un groupe carboxyle (COOH), c'est, avec l'acide 2-nitrobenzoïque et l'acide 4-nitrobenzoïque, l'un des trois isomères de l'acide nitrobenzoïque, le composé méta. Il se présente sous la forme d'une poudre cristalline jaunâtre avec une faible odeur[3]. Ce composé est notamment utilisé comme précurseur de l'acide 3-aminobenzoïque, qui est utilisé pour préparer certains colorants.
| Acide 3-nitrobenzoïque | |
  |
|
| Identification | |
|---|---|
| Nom systématique | acide 3-nitrobenzoïque |
| Synonymes |
acide métanitrobenzoïque, acide m-nitrobenzoïque |
| No CAS | |
| No ECHA | 100.004.099 |
| PubChem | 8497 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline jaunâtre, faible odeur[1] |
| Propriétés chimiques | |
| Formule | C7H5NO4 [Isomères] |
| Masse molaire[2] | 167,118 9 ± 0,007 4 g/mol C 50,31 %, H 3,02 %, N 8,38 %, O 38,29 %, |
| Propriétés physiques | |
| T° fusion | 140 à 141 °C[1] |
| Solubilité | 3 g L−1 (eau, 25 °C) |
| Masse volumique | 1,49 g cm−3 (20 °C)[1] |
| T° d'auto-inflammation | 490 °C[1] |
| Point d’éclair | 190 °C (coupelle fermée)[1] |
| Précautions | |
| SGH[1] | |
 Attention |
|
| Écotoxicologie | |
| LogP | 1,83[1] |
| Composés apparentés | |
| Isomère(s) | acide 2-nitrobenzoïque acide 4-nitrobenzoïque |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Avec un pKA de 3,47[3], l'acide 3-nitrobenzoïque est environ dix fois plus acide que l'acide benzoïque. La base conjuguée de l'acide benzoïque est stabilisée par la présence du groupe nitro attracteur d'électrons (effet -M), ce qui explique son acidité accrue par rapport à l'acide benzoïque non substitué[4]. Toutefois, la position méta du groupe nitro fait que son effet sur le groupe carboxylate est moindre, par exemple comparé à l'acide 2-nitrobenzoïque (ortho) qui a lui un pKA de 2,22[5].
L'acide 3-nitrobenzoïque est généralement soluble dans les solvants oxygénés et chlorés[6], et peu soluble dans l'eau (3 g/l à 25 °C[1]). Il est combustible mais peu inflamable (point d'éclair de 190 °C et point d'auto-inflammation de 490 °C[1]). Ses solutions aqueuses réagissent de manière acide. Il présente un risque d'explosion de poussières lorsqu'il est sous une forme très finement répartie (poudre, poussière), qu'il est tourbillonné en quantité suffisante dans l'air et qu'une source d'inflammation (flamme, étincelle, décharge électrostatique, etc.) est présente[1].
Réactivité
La présence à la fois d'acide carboxylique et d'un groupe fonctionnel nitro désactive le cycle, empêchant alors toute réaction de substitution aromatique électrophile[7].
Synthèse
L'acide 3-nitrobenzoïque peut être préparé par nitration de l'acide benzoïque à basse température, formant également l'acide 2-nitrobenzoïque et l'acide 4-nitrobenzoïque comme sous-produits, avec des rendements respectifs d'environ 20 % et 1,5 %[8] Cette régiosélectivité s'explique par l'effet attracteur (+I) du groupe carboxyle, orienteur méta en substitution électrophile aromatique.
Une voie moins efficace passe par la nitration du benzoate de méthyle, suivie d'une hydrolyse[9] :
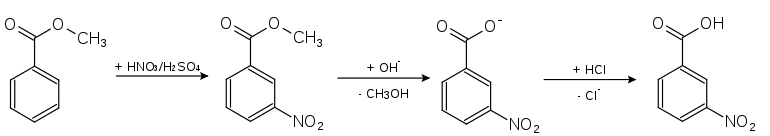
Il est également possible de provoquer le clivage oxydatif de la liaison C–C de la 3-nitroacétophénone en acide arylcarboxylique correspondant[10]. Une autre synthèse passe par l'oxydation du 3-nitrobenzaldéhyde.
Sécurité
Le composé présente probablement une toxicité modeste, avec une DL50 (in vitro, souris) de 640 mg/kg. Il peut provoquer une irritation de la peau et des yeux avec des symptômes d'exposition tels que la méthémoglobine, une sensibilisation, une irritation et des lésions cornéennes[11]
Références
- Entrée « 3-Nitrobenzoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-02-02 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Dissociation Constants Of Organic Acids And Bases », sur zirchrom.com (consulté le )
- (en-US) « 20.4 Substituent Effects on Acidity », Chemistry LibreTexts,
- CRC Handbook of Tables for Organic Compound Identification, 3e éd., 1984 (ISBN 0-8493-0303-6).
- (en) Ashford, Edith, vol. 1, Oxford University Press, coll. « Benezit Dictionary of Artists », (DOI 10.1093/benz/9780199773787.article.b00007872)
- (en-US) « 16.7: Nucleophilic Aromatic Substitution », Chemistry LibreTexts, (lire en ligne, consulté le )
- Takao Maki, Kazuo Takeda, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a03_555)
- Oliver Kamm et J.B. Segur, m-Nitrobenzoic Acid, Org. Synth., 1923, vol. 3, 73, DOI 10.15227/orgsyn.003.0073
- (en) Meichao Li, Zhenlu Shen, Liang Xu et Shengpeng Wang, « Oxidative C–C Bond Cleavage for the Synthesis of Aryl Carboxylic Acids from Aryl Alkyl Ketones », Synlett, vol. 29, no 11, , p. 1505–1509 (ISSN 0936-5214, DOI 10.1055/s-0037-1609751)
- (en-US) institutionnel=NOAA Office of Response and Restoration, US GOV, « M-Nitrobenzoic Acid », cameochemicals.noaa.gov, sur cameochemicals.noaa.gov (consulté le )