2-Méthylfurane
Le 2-méthylfurane est un composé chimique de formule CH3C4H3O. C'est un dérivé du furane et un isomère du 3-méthylfurane. Il se présente sous la forme d'un liquide volatil incolore à l'odeur d'éther chocolatée faiblement soluble dans l'eau. Il se décompose lorsqu'il est fortement chauffé. Il est présent dans le myrte, la lavande, la fumée de cigarette ainsi que dans l'odeur des moisissures, et peut être utilisé comme arôme dans l'industrie agroalimentaire.
| 2-Méthylfurane | |
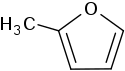
| |
| Structure du 2-méthylfurane | |
| Identification | |
|---|---|
| Nom UICPA | 2-méthylfurane |
| No CAS | |
| No ECHA | 100.007.814 |
| No CE | 208-594-5 |
| No RTECS | LU2625000 |
| PubChem | 10797 |
| ChEBI | 88912 |
| SMILES | |
| InChI | |
| Apparence | Liquide incolore volatil et très inflammable à l'odeur d'éther[1] |
| Propriétés chimiques | |
| Formule | C5H6O [Isomères] |
| Masse molaire[2] | 82,100 5 ± 0,004 7 g/mol C 73,15 %, H 7,37 %, O 19,49 %, |
| Propriétés physiques | |
| T° fusion | −89 °C[1] |
| T° ébullition | 64 °C[1] |
| Solubilité | 3 g·L-1[1] à 20 °C |
| Masse volumique | 0,89 g·cm-3[1] à 20 °C |
| Point d’éclair | −27 °C[1] |
| Pression de vapeur saturante | 13,9 kPa[1] à 20 °C |
| Viscosité dynamique | 4 mPa·s-1[1] à 20 °C |
| Précautions | |
| SGH[1] | |
  Danger |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
On peut obtenir du 2-méthylfurane par réaction de peroxyde d'hydrogène H2O2 sur du pipérylène CH3=CH–CH=CH–CH3 catalysée par du palladium[3]. Il est produit industriellement à partir d'alcool furfurylique HOCH2C4H3O par hydrogénolyse en présence de cuivre en phase gazeuse, ou à partir de furfural CHOC4H3O par séquence hydrogénation-hydrogénolyse, également en phase gazeuse[4].
Il a été utilisé comme carburant à haut indice d'octane pendant la seconde Guerre mondiale.
Notes et références
- Entrée « 2-Methylfuran » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 juin 2018 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) C. W. Jones, Applications of Hydrogen Peroxide and Derivatives, Royal Society of Chemistry, 1999, p. 102 (ISBN 0-85404-536-8)
- (en) L. W. Burnett, I. B. Johns, R. F. Holdren et R. M. Hixon, « Production of 2-Methylfuran by Vapor-Phase Hydrogenation of Furfural », Industrial Engineering Chemistry, vol. 40, no 3, , p. 502-505 (DOI 10.1021/ie50459a034, lire en ligne)
