Trichlorure d'arsenic
Le trichlorure d'arsenic, également appelé trichloroarsane, est un composé inorganique de formule brute AsCl3. C'est un liquide huileux incolore soluble dans l'alcool, l'éther, l'acide chlorhydrique et le bromure d'hydrogène.
| Trichlorure d'arsenic | ||
.svg.png.webp)
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | trichloroarsane | |
| Synonymes |
chlorure d'arsenic(III), trichlorure d'arsenic, beurre d'arsenic, solution de Valagin |
|
| No CAS | ||
| No ECHA | 100.029.144 | |
| No CE | 232-059-5 | |
| No RTECS | CG1750000 | |
| PubChem | ||
| SMILES | ||
| InChI | ||
| Apparence | liquide fumant huileux incolore, d'odeur âcre | |
| Propriétés chimiques | ||
| Formule | AsCl3 [Isomères] |
|
| Masse molaire[1] | 181,281 ± 0,006 g/mol As 41,33 %, Cl 58,67 %, |
|
| Propriétés physiques | ||
| T° fusion | −16.2 °C | |
| T° ébullition | 130.2 °C | |
| Masse volumique | 2,163 g·cm3 | |
| Pression de vapeur saturante | 1,17 kPa (20 °C) | |
| Précautions | ||
| SGH | ||
    |
||
| NFPA 704 | ||
| Écotoxicologie | ||
| DL50 | 48 mg/kg | |
| LogP | 1,69 | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Il est utilisé en tant qu'intermédiaire en synthèse, lors de la fabrication de composés organo-arséniés[2].
Structure
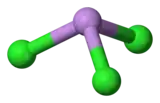
C'est une molécule de géométrie pyramidale de symétrie C3v. La liaison As-Cl mesure 2,161 Å et l'angle Cl-As-CL est de 98° 25'± 30[3] - [4]. Elle possède quatre modes de vibrations: ν1(A1) 416, ν2(A1) 192, ν3 393, et ν4(E) 152 cm−1. Le trichlorure d'arsenic possède essentiellement des liaisons covalentes prépondérantes, qui expliquent que son point de fusion soit si faible.
Synthèse
Ce composé est obtenu après distillation d'oxyde d'arsenic(III) traité par du chlorure d'hydrogène, selon la réaction :
As2O3 + 6 HCl → 2 AsCl3 + 3 H2O
On peut également le préparer par chloration de l'arsenic à 80-85 ° C, cette méthode nécessite l'utilisation d'arsenic élémentaire[5].
2 As + 3 Cl2 → 2 AsCl3
Une autre méthode consiste a préparer le trichlorure d'arsenic par réaction entre l'oxyde d'arsenic et le (mono)-chlorure de soufre. Cette méthode nécessite un appareil simple et fonctionne efficacement[6].
2 As2O3 + 6 S2Cl2 → 4 AsCl3 + 3 SO2 + 9 S
En laboratoire il est aussi possible de porter à reflux de l'oxyde d'arsenic(III) en présence de chlorure de thionyle[7] :
2 As2O3 + 3 SOCl2 → 2 AsCl3 + 3 SO2
Réactions
L'hydrolyse du trichlorure d'arsenic en milieux aqueux conduit à la formation d'acide arsénique et d'acide chlorhydrique :
AsCl3 + 3 H2O → As(OH)3 + 3 HCl
Bien que l'AsCl3 soit moins sensible que le PCl3, il émet toujours à l'air humide[8].
Il subit une redistribution lors du traitement avec As2O3 pour donner le polymère inorganique AsOCl. Avec les sources de chlorure, AsCl3 forme des sels d'anion [AsCl4]−. La réaction avec le bromure de potassium et l'iodure de potassium donne respectivement du tribomure d'arsenic et du triiodure d'arsenic.
Le trichlorure d'arsenic est utilisé en chimie organoarsénique ; par exemple, la triphénylarsine est dérivée d'AsCl3[9] :
Sécurité
Les composés de l'arsenic sont en général fortement toxiques et génotoxiques, en raison de leur volatilité et de leur solubilité. Le trichlrorure d'arsenic est irritant pour la peau, les yeux et les muqueuses et très toxique par inhalation ou ingestion.
C'est une substance classée « extrêmement dangereuse » par les États-Unis, comme le stipule l'Emergency Planning and Community Right-to-Know Act (en). Le trichlorure d'arsenic est soumis à des exigences de déclaration strictes par les organismes qui produisent, stockent, ou l'exploitent en grande quantité[10].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Sabina C. Grund, Kunibert Hanusch et Hans Uwe Wolf, « Arsenic and Arsenic Compounds », dans Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, (ISBN 978-3-527-30673-2, DOI 10.1002/14356007.a03_113.pub2, lire en ligne), a03_113.pub2
- Roland Muxart, Odilon Chalvet et Pascaline Daudel, « Réaction d'échange entre le phosphore et le trichlorure de phosphore », Journal de Chimie Physique, vol. 46, , p. 373–374 (ISSN 0021-7689, DOI 10.1051/jcp/1949460373, lire en ligne, consulté le )
- (en) Jean Galy, Renée Enjalbert, Pierre Lecante et Andrzej Burian, « AsCl 3 : From the Crystalline to the Liquid State. XRD (176 < T (K) < 250) and WAXS (295 K) Studies † », Inorganic Chemistry, vol. 41, no 4, , p. 693–698 (ISSN 0020-1669 et 1520-510X, DOI 10.1021/ic0102788, lire en ligne, consulté le )
- Sabina C. Grund, Kunibert Hanusch et Hans Uwe Wolf, « Arsenic and Arsenic Compounds », dans Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, (ISBN 3-527-30673-0, lire en ligne)
- (en) R. C. Smith, « Manufacture of Arsenic Trichloride. », Journal of Industrial & Engineering Chemistry, vol. 11, no 2, , p. 109–110 (ISSN 0095-9014 et 1943-2968, DOI 10.1021/ie50110a009, lire en ligne, consulté le )
- Sushil K. Pandey, Alexander Steiner, Herbert W. Roesky et Smuruthi Kamepalli, « Arsenic(III) chloride », dans Inorganic Syntheses, John Wiley & Sons, Inc., (ISBN 978-0-470-13262-3, DOI 10.1002/9780470132623.ch24, lire en ligne), p. 148–150
- Egon Wiberg et A. F. Holleman, Inorganic chemistry, Academic Press, (ISBN 0-12-352651-5 et 978-0-12-352651-9, OCLC 48056955, lire en ligne)
- R. L. Shriner et Calvin N. Wolf, « Tetraphenylarsonium Chloride Hydrochloride », dans Organic Syntheses, John Wiley & Sons, Inc., (ISBN 0-471-26422-9, lire en ligne), p. 95–95
- Nicholas P. Cheremisinoff, « The List of Extremely Hazardous Substances and Their Threshold Planning Quantities (Alphabetical Order) », dans Handbook of Emergency Response to Toxic Chemical Releases, Elsevier, (ISBN 978-0-8155-1365-0, lire en ligne), p. 255–260
