Thapsigargine
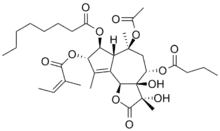
La thapsigargine ou Tg est une molécule de type lactone sesquiterpène polyoxygénée structurellement classée dans la famille des guaianolides. Son squelette est tricyclique et contient une gamma-lactone.
.jpg.webp)
On ne sait pas encore synthétiser la thapsigargine ; elle est extraite d'une plante qui pousse dans le bassin méditerranéen : Thapsia garganica[1], dont la molécule a été isolée en 1978 par Christensen, Rasmussen et Sandberg[2]. Cette plante était déjà citée par Hippocrate en 400 avant JC, alors utilisée contre le rhumatisme et certains problèmes pulmonaires[3].
Activité biochimique
La thapsigargine est une puissante inhibitrice non compétitive des enzymes ubiquitaires SERCAs (sarco/réticulum endoplasmique Ca 2+ ATPases)[4]. Ce faisant, elle augmente le taux de calcium dans le lumen du réticulum endoplasmique, et engendre une apoptose cellulaire.
La thapsigargine, dans le modèle animal murin notamment, selon des études publiée dans les années 1980, s'est aussi montrée être un promoteur de tumeur au sein de cellules de mammifères[5] - [6] - [7] - [8].
Le caractère cytotoxique de cette molécule a fait suggérer qu'elle pourrait être utilisée pour tuer certains types de cellules cancéreuses[9].
Effet intracellulaire
Dans la cellule, la thapsigargine a pour effet d'augmenter le taux de calcium dans le cytosol.
Elle le fait en bloquant la capacité de la cellule à pomper le calcium dans les réticulums endoplasmique et sarcoplasmique. L'épuisement des réserves peut activer secondairement les canaux calciques de la membrane plasmique, permettant un afflux de calcium dans le cytosol.
L'épuisement des réserves de calcium du réticulum endoplasmique (RE) entraîne un stress du RE et l'activation de la réponse protéique dépliée[10]. Le stress du RE non résolu peut conduire de manière cumulative à la mort cellulaire[11] - [12]. L'épuisement prolongé des réserves peut protéger contre la ferroptose via le remodelage des phospholipides synthétisés par l'ER[13].
Le traitement à la thapsigargine et la déplétion calcique du RE qui en résulte inhibent l' autophagie indépendamment de l'UPR[14] - [15].
Usages
La thapsigargine est utilisée dans certaines expérimentations étudiant les impacts de l'augmentation des taux de calcium cytosolique et de l'épuisement du calcium du réticulum endoplasmique[16].
Une étude récente (2021) de l'université de Nottingham a conclu à des résultats prometteurs concernant son utilisation contre la Covid-19 et d'autres coronavirus.
Biosynthèse
La biosynthèse complète de la thapsigargine n'est pas encore élucidée. Une voie de biosynthèse proposée commence avec le farnésyl pyrophosphate. Une première étape est contrôlée par l'enzyme germacrène B synthase. Dans une seconde étape, la position C(8) est facilement activée pour une oxydation allylique due à la position de la double liaison. L'étape suivante est l'ajout de la fraction acyloxy par une P450 acétyltransférase ; qui est une réaction bien connue pour la synthèse d'un diterpène, le taxol. Lors d'une troisième étape, le cycle lactone est formé par une enzyme cytochrome P450 utilisant NADP +. Avec le groupe butyloxy sur le C(8), la formation ne générera que le cycle 6,12-lactone. Une quatrième étape est une époxydation qui initie la dernière étape de la formation de base du guaianolide. Dans la cinquième étape, une enzyme P450 ferme la structure 5 + 7 guaianolide. La fermeture du cycle est importante, car elle se fera par époxydation 1,10 — afin de conserver la double liaison 4,5 — nécessaire dans la thapsigargine. On ignore encore si les modifications secondaires du guaianolide se produisent avant ou après la formation de la thapsigargine, mais devront être prises en compte lors de l'élucidation de la véritable biosynthèse. Plusieurs de ces enzymes sont des P450, par conséquent l'oxygène et le NADPH sont probablement essentiels à cette biosynthèse, ainsi que d'autres cofacteurs tels que Mg 2+ et Mn 2+ potentiellement nécessaires[17].
Tentatives de synthèse de la thapsigargine ou d'analogues
Au début des années 2010, à l'Université de Paris 5, des chimistes ont utilisé les outils de la chimie organique pour d'abord synthétiser, avec une bonne sélectivité et un bon rendement, un modèle 8-desoxy-bicyclo[5.3.0]decadiénone, présentant une structure assez similaire à celle du squelette de la thapsigargine. Cette synthèse a été faite via une réaction clé de Pauson-Khand allène-yne, catalysée par un complexe de rhodium. Un époxyde optiquement enrichi a ensuite été utilisé pour produire la partie Sud de la thapsigargine (le « motif lactonique »). Puis les centres C6 et C8 ont été synthétisés respectivement par alcynylation/réduction asymétrique et par propargylation énantiosélective. On a alors pu obtenir en dix-sept étapes un produit énantiopure possédant les centres chiraux C6, C7 et C8[3]. Une autre méthode, créant plus rapidement (en dix étapes) la partie Sud de la molécule via une réaction de dihydroxylation a abouti à un produit racémique possédant les centres chiraux C6, C7, C8 et C11 et le motif lactonique[3]. Une étude méthodologique de la réaction de Pauson-Khand allénol-yne intramoléculaire a aussi permis de produire des composés bicycliques synthétisés en série acétal et NTs[3].
Au même moment, une autre voie était explorée pour synthétiser le squelette bicyclique[18] - [19] - [20] de cette molécule (réaction de métathèse ényne cyclisante).
Recherche
Comme l'inhibition de l’enzyme SERCA est un mécanisme déjà utilisé pour cibler les tumeurs solides, la thapsigargine a suscité l'intérêt de la recherche contre le cancer (notamment testées au début des années 2010 contre le cancer de la prostate non-hormono dépendant)[21] - [22]. Un promédicament de la thapsigargine, la mipsagargine fait l'objet d'essais cliniques pour le traitement du glioblastome[23] - [24] - [25] - [26]. On envisage aussi de l'utiliser contre les cancers ovariens chimiorésistants.
L'activité biologique de cette molécule a aussi suscité des recherches sur sa synthèse en laboratoire. À ce jour, trois synthèses distinctes ont été rapportées, respectivement par Steven V. Ley[27], par Phil Baran[28] et par P. Andrew Evans[29].
Des études précliniques ont démontré que d'autres effets de la thapsigargine incluent la suppression de l'activité des récepteurs nicotiniques de l'acétylcholine dans les neurones du plexus sous-muqueux de l'iléon[30] et du ganglion cervical supérieur du rat[31].
Les travaux de l'université de Nottingham indiquent sa promesse en tant qu'antiviral à large spectre, avec une activité contre le virus Covid-19 (SARS-CoV-2), un virus du rhume, le virus respiratoire syncytial (RSV) et le virus de la grippe A[32].
Notes et références
- (en) Rasmussen U, Brøogger Christensen S, Sandberg F, « Thapsigargine and thapsigargicine, two new histamine liberators from Thapsia garganica L. », Acta Pharm. Suec., vol. 15, no 2, , p. 133–140 (PMID 79299)
- Rasmussen U (1978). Thapsigargine and thapsigargicine, two new histamine liberators from Thapsia garganica L.
- Aurélien Tap (2013) Vers la synthèse totale de la Thapsigargine inhibiteur de l’enzyme SERCA ; Thèse de doctorat en Chimie organique ; Soutenue le 16-12-2013 à Paris 5 (École doctorale Médicament, toxicologie, chimie, environnement). URL=https://wo.app.u-paris.fr/cgi-bin/WebObjects/TheseWeb.woa/wa/show?t=503&f=1106 ou https://www.theses.fr/2013PA05P619/document
- (en) « Use of thapsigargin to study Ca2+ homeostasis in cardiac cells », Biosci. Rep., vol. 15, no 5, , p. 341–9 (PMID 8825036, DOI 10.1007/BF01788366)
- (en) Hakii, Fujiki, H., Suganuma, M. et Nakayasu, M., « Thapsigargin, a histamine secretagogue, is a non-12-O-tetradecanolphorbol-13-acetate (TPA) type tumor promoter in two-stage mouse skin carcinogenesis », Journal of Cancer Research and Clinical Oncology, vol. 111, no 3, , p. 177–181 (PMID 2426275, DOI 10.1007/BF00389230)
- Thastrup, O., Cullen, P. J., Drøbak, B. K., Hanley, M. R., & Dawson, A. P. (1990). Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2 (+)-ATPase. Proceedings of the National Academy of Sciences, 87(7), 2466-2470.
- (en) H Takemura, A R Hughes, O Thastrup et J W Putney, « Activation of Calcium Entry by the Tumor Promoter Thapsigargin in Parotid Acinar Cells », Journal of Biological Chemistry, vol. 264, no 21, , p. 12266–12271 (ISSN 0021-9258, DOI 10.1016/s0021-9258(18)63852-9, lire en ligne, consulté le )
- (en) T R Jackson, S I Patterson, O Thastrup et M R Hanley, « A novel tumour promoter, thapsigargin, transiently increases cytoplasmic free Ca2+ without generation of inositol phosphates in NG115-401L neuronal cells », Biochemical Journal, vol. 253, no 1, , p. 81–86 (ISSN 0264-6021 et 1470-8728, DOI 10.1042/bj2530081, lire en ligne, consulté le )
- (en) Nhu Thi Quynh Doan, Eleonora Sandholdt Paulsen, Pankaj Sehgal et Jesper Vuust Møller, « Targeting thapsigargin towards tumors », Steroids, sI: Isoprenoids, vol. 97, , p. 2–7 (ISSN 0039-128X, DOI 10.1016/j.steroids.2014.07.009, lire en ligne, consulté le )
- (en) Malhotra et Kaufman, « The endoplasmic reticulum and the unfolded protein response », Seminars in Cell & Developmental Biology, vol. 18, no 6, , p. 716–731 (PMID 18023214, PMCID 2706143, DOI 10.1016/j.semcdb.2007.09.003)
- (en) Hetz et Papa, « The Unfolded Protein Response and Cell Fate Control », Molecular Cell, vol. 69, no 2, , p. 169–181 (PMID 29107536, DOI 10.1016/j.molcel.2017.06.017)
- (en) Sano et Reed, « ER stress-induced cell death mechanisms », Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, vol. 1833, no 12, , p. 3460–3470 (ISSN 0167-4889, PMID 23850759, PMCID 3834229, DOI 10.1016/j.bbamcr.2013.06.028)
- (en) Xin, Mueller, Pfeiffer et Kraft, « MS4A15 drives ferroptosis resistance through calcium-restricted lipid remodeling », Cell Death & Differentiation, , p. 1–17 (ISSN 1476-5403, PMID 34663908, DOI 10.1038/s41418-021-00883-z, lire en ligne)
- (en) Engedal, Torgersen, Guldvik et Barfeld, « Modulation of intracellular calcium homeostasis blocks autophagosome formation », Autophagy, vol. 9, no 10, , p. 1475–1490 (ISSN 1554-8627, PMID 23970164, DOI 10.4161/auto.25900)
- (en) Ganley, Wong, Gammoh et Jiang, « Distinct Autophagosomal-Lysosomal Fusion Mechanism Revealed by Thapsigargin-Induced Autophagy Arrest », Molecular Cell, vol. 42, no 6, , p. 731–743 (PMID 21700220, PMCID 3124681, DOI 10.1016/j.molcel.2011.04.024, lire en ligne)
- Thastrup, O., Dawson, A. P., Scharff, O., Foder, B., Cullen, P. J., Drøbak, B. K., … et Hanley, M. R. (1989). Thapsigargin, a novel molecular probe for studying intracellular calcium release and storage. Agents and actions, 27(1), 17-23.
- (en) Drew, D.P., Krichau, N., Reichwald, K. et Simonsen, H.T., « Guaianolides in apiaceae: perspectives on pharmacology and biosynthesis », Phytochem Rev., vol. 8, no 3, , p. 581–599 (DOI 10.1007/s11101-009-9130-z)
- (en) Sundar Neelakantan, Shama Nasim, Monica L. Guzman et Craig T. Jordan, « Aminoparthenolides as novel anti-leukemic agents: Discovery of the NF-κB inhibitor, DMAPT (LC-1) », Bioorganic & Medicinal Chemistry Letters, vol. 19, no 15, , p. 4346–4349 (ISSN 0960-894X, DOI 10.1016/j.bmcl.2009.05.092, lire en ligne, consulté le )
- (en) S.Brøgger Christensen et Elsebeth Norup, « Absolute configurations of the histamine liberating sesquiterpene lactones thapsigargin and trilobolide », Tetrahedron Letters, vol. 26, no 1, , p. 107–110 (ISSN 0040-4039, DOI 10.1016/s0040-4039(00)98480-6, lire en ligne, consulté le )
- (en) Stephen P. Andrews, Matthew Ball, Frank Wierschem et Ed Cleator, « Total Synthesis of Five Thapsigargins: Guaianolide Natural Products Exhibiting Sub-Nanomolar SERCA Inhibition », Chemistry - A European Journal, vol. 13, no 20, , p. 5688–5712 (ISSN 0947-6539 et 1521-3765, DOI 10.1002/chem.200700302, lire en ligne, consulté le )
- (en) Samuel R. Denmeade, Xiaohui S. Lin et John T. Isaacs, « Role of programmed (apoptotic) cell death during the progression and therapy for prostate cancer », The Prostate, vol. 28, no 4, , p. 251–265 (ISSN 1097-0045, DOI 10.1002/(SICI)1097-0045(199604)28:4<251::AID-PROS6>3.0.CO;2-G, lire en ligne, consulté le )
- (en) Samuel R. Denmeade et John T. Isaacs, « The SERCA pump as a therapeutic target: Making a “smart bomb” for prostate cancer », Cancer Biology & Therapy, vol. 4, no 1, , p. 21–29 (ISSN 1538-4047, DOI 10.4161/cbt.4.1.1505, lire en ligne, consulté le )
- (en) Denmeade, Mhaka, Rosen et Brennen, « Engineering a Prostate-Specific Membrane Antigen–Activated Tumor Endothelial Cell Prodrug for Cancer Therapy », Science Translational Medicine, vol. 4, no 140, , p. 140ra86 (PMID 22745436, PMCID 3715055, DOI 10.1126/scitranslmed.3003886)
- (en) Andersen, López, Manczak et Martinez, « Thapsigargin—From Thapsia L. To Mipsagargin », Molecules, vol. 20, no 4, , p. 6113–27 (PMID 25856061, PMCID 6272310, DOI 10.3390/molecules20046113)
- « Mipsagargin », NCI Drug Dictionary, National Cancer Institute,
- « Clinical Trials: Mipsagargin », National Cancer Institute
- (en) Ball, Andrews, Wierschem et Cleator, « Total Synthesis of Thapsigargin, a Potent SERCA Pump Inhibitor », Organic Letters, vol. 9, no 4, , p. 663–6 (PMID 17256950, DOI 10.1021/ol062947x)
- (en) Chu, Smith, Felding et Baran, « Scalable Synthesis of (−)-Thapsigargin », ACS Central Science, vol. 3, no 1, , p. 47–51 (PMID 28149952, PMCID 5269647, DOI 10.1021/acscentsci.6b00313)
- (en) Chen et Evans, « A Concise, Efficient and Scalable Total Synthesis of Thapsigargin and Nortrilobolide from (R)-(-)-Carvone », J. Am. Chem. Soc., vol. 139, no 17, , p. 6046–6049 (PMID 28422492, DOI 10.1021/jacs.7b01734)
- (en) Glushakov, Glushakova et Skok, « Modulation of nicotinic acetylcholine receptor activity in submucous neurons by intracellular messengers », Journal of the Autonomic Nervous System, vol. 75, no 1, , p. 16–22 (ISSN 0165-1838, PMID 9935265, DOI 10.1016/S0165-1838(98)00165-9)
- (en) Voitenko, Bobryshev et Skok, « Intracellular regulation of neuronal nicotinic cholinorceptors », Neuroscience and Behavioral Physiology, vol. 30, no 1, , p. 19–25 (ISSN 0097-0549, PMID 10768368, DOI 10.1007/BF02461388)
- https://scitechdaily.com/powerful-antiviral-treatment-for-covid-19-discovered-that-could-change-how-epidemics-are-managed/
<15. Dey. S. ; Bajaj, S. O « Thapsigargine, un médicament anticancéreux prometteur : une perspective vers la synthèse totale » Communication synthétique 2018, 48(1), 1-13/>
Voir aussi
Bibliographie
- (en) « Thapsigargin-coated intraocular lenses inhibit human lens cell growth », Nat. Med., vol. 3, no 9, , p. 1026-1028 (PMID 9288732, DOI 10.1038/nm0997-1026).
- (en) Ibaraki N, « A brighter future for cataract surgery », Nat. Med., vol. 3, no 9, , p. 958-960 (PMID 9288718, DOI 10.1038/nm0997-958).
- (en) Nhu Quynh Doan et Soren Christensen, « Thapsigargin, Origin, Chemistry, Structure-Activity Relationships and Prodrug Development », Current Pharmaceutical Design, vol. 21, no 38, , p. 5501-5517 (ISSN 1381-6128, DOI 10.2174/1381612821666151002112824, lire en ligne, consulté le ).