Tétrachlorure de dibore
Le tétrachlorure de dibore est un composé chimique de formule B2Cl4. Il s'agit d'un liquide incolore soluble dans l'eau en donnant de l'acide borique B(OH)3 et de l'acide chlorhydrique HCl.
| Tétrachlorure de dibore | |
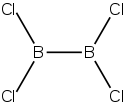
| |
| Structure du tétrachlorure de dibore | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 139548 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | B2Cl4 [Isomères] |
| Masse molaire[1] | 163,434 ± 0,022 g/mol B 13,23 %, Cl 86,77 %, |
| Propriétés physiques | |
| T° fusion | −93 °C |
| T° ébullition | 65 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
Comme les autres tétrahalogénures de bore, il se décompose à température ambiante[2] à une vitesse qui s'accélère sous l'effet catalytique des produits de la décomposition :
- B2Cl4 → 1⁄n (BCl)n + BCl3.
Le tétrachlorure de dibore s'enflamme spontanément au contact de l'air :
Il fixe facilement l'hydrogène H2 à température ambiante[3] :
Il peut être obtenu en faisant réagir du trichlorure de bore BCl3 avec du mercure ou du cuivre en présence de décharges électriques :
Cette réaction peut être divisée en trois étapes[3] :
Il peut être utilisé comme précurseur dans la synthèse de composés organiques du bore, par exemple en réagissant avec l'éthylène C2H4[4] :
- CH2=CH2 + B2Cl4 → Cl2B–CH2–CH2–BCl2.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Ullmann's Fine Chemicals, John Wiley & Sons, 2013, p. 351, (ISBN 978-3-527-68357-4).
- (en) Grant Urry, Thomas Wartik, R. E. Moore et H. I. Schlesinger, « The Preparation and Some of the Properties of Diboron Tetrachloride, B2Cl4 », Journal of the American Chemical Society, vol. 76, no 21, , p. 5293-5298 (DOI 10.1021/ja01650a010, lire en ligne)
- (en) Grant Urry, James Kerrigan, Theran D. Parsons et H. I. Schlesinger, « Diboron Tetrachloride, B2Cl4, as a Reagent for the Synthesis of Organo-boron Compounds. I. The Reaction of Diboron Tetrachloride with Ethylene », Journal of the American Chemical Society, vol. 76, no 21, , p. 5299-5301 (DOI 10.1021/ja01650a011, lire en ligne)