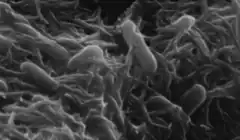
Shewanella oneidensis
Shewanella oneidensis est une bactérie anaérobie facultative capable aussi bien de réduire des ions de métaux lourds toxiques que de réduire l'oxygène. Cette protéobactérie a été isolée pour la première fois à partir du lac Oneida (État de New York) en 1988, d'où son nom[1]. Cette espèce est nommée Shewanella oneidensis MR-1, pour « réductrice de manganèse » en anglais[alpha 1], qui est une des caractéristiques de cet organisme.
| Règne | Bacteria |
|---|---|
| Embranchement | Proteobacteria |
| Classe | Gammaproteobacteria |
| Ordre | Alteromonadales |
| Famille | Shewanellaceae |
| Genre | Shewanella |
James M. Shewan, 1985
Shewanella oneidensis est particulièrement étudiée comme micro-organisme à réduction dissimilatrice de métaux pour son métabolisme anaérobie dans les milieux contaminés par des métaux et des métaux lourds comme le fer, le plomb et l'uranium. Des recherches laissent penser qu'elle pourrait réduire les ions de mercure HgII en mercure élémentaire[2] Hg0 et les ions d'argent AgI en argent élémentaire[3] Ag0. La respiration cellulaire de ces bactéries ne se limite cependant pas aux métaux lourds et peut également utiliser des thiosulfates - S2O32-42–, des nitrates NO3– et des chromates CrO42– comme accepteurs d'électrons en milieu anaérobie.
Applications en recherche
Applications dans la réduction des métaux
S. oneidensis MR-1 appartient à une classe de bactéries dénommée les "bactéries réductrices de métaux par dissimilation" (DMRB en anglais), de par leur capacité à coupler la réduction des métaux avec leur métabolisme. Les moyens utilisés pour réduire les métaux sont sujets à débat, de par le fait que les expériences récentes ayant utilisé la Microscopie Électronique à Balayage et la Microscopie Électronique à Transmission ont révélé des protusions structurelles anormales ressemblant à des filaments qui sont supposés être impliqués dans la réduction des métaux. Ce processus de production de filaments externes est complètement absent de la respiration bactérienne conventionnelle et constitue la problématique de recherche de beaucoup d'études en cours.
Les mécanismes de résistance de cette bactérie et de son utilisation des ions de métaux lourds est profondément liée à la structure de ses voies métaboliques. Les transporteurs putatifs de reflux multidrogues, les protéines de détoxification, les facteurs sigma extracytoplasmiques et les régulateurs de domaines PAS ont démontré avoir une activité d'expression plus forte en présence d'un métal lourd. La protéine SO3300 de classe du Cytochrome c a également une transcription plus forte[4]. Par exemple, lors de la réduction de l'Uranium VI, certains cytochromes comme MtrC et OmcA sont utilisés pour former des nanoparticules de UO2 et les associer à des biopolymères[5].
Applications en nanotechnologies
Shewanella oneidensis MR-1 peut changer l'état d'oxydation des métaux. Ces processus microbiens ont ouvert la voie à l'exploration d'applications innovantes, comme la biosynthèse de nanomatériaux métalliques [3]. Contrairement aux méthodes chimiques et physiques habituelles, les processus microbiens de synthèse des nanomatériaux peuvent être réalisés en phase aqueuse dans des conditions non nocives pour l'environnement. Cette approche est devenue un centre d'intérêt dans la recherche en cours en nanotechnologies "vertes" en relation avec le développement durable. En effet, il existe quantité d'organismes pouvant être utilisés pour synthétiser des nanomatériaux métalliques, parmi lesquels la bactérie Shewanella oneidensis qui peut réduire une grande variété d'ions métalliques dans le milieu extracellulaire, ce qui facilite grandement l'extraction de ces nanomatériaux. Les chaînes de transport d'électrons extracellulaires permettant de transférer les électrons à travers les membranes cellulaires sont relativement bien caractérisées, en particulier la membrane externe des cytochromes C MtrC et OmcA[6]. Une étude récente a suggéré qu'il serait possible de changer la taille et l'activité des nanoparticules biogéniques extracellulaires via l'expression contrôlée des gènes codant les protéines de surface. On peut citer comme bon exemple la synthèse d'une nanoparticule d'argent par Shewanella oneidensis, lors de laquelle son activité antibactérienne peut être influencée par l'expression de cytochromes C sur la membrane externe. Les nanoparticules d'argent sont considérées comme faisant partie d'une nouvelle génération d'agents antimicrobiens, car elles présentent une activité bactériolytique envers un grand nombre de bactéries et elles gagnent en intérêt dans un contexte de résistance sans cesse croissante aux antibiotiques par les bactéries pathogènes[3]. Shewanella a été utilisée en laboratoire pour réduire des quantités considérables de palladium et pour déchlorer jusqu'à près de 70 % de biphényles polychlorés[7]. La production de nanoparticules par Shewanella oneidensis MR-1 est étroitement associée à la voie MTR[3] (cas des nanoparticules d'argent), ou à la voie de l'hydrogénase[8] (cas des nanoparticules de palladium).
Formation de pellicule
La pellicule constitue une variété de biofilm formée à l'interface air-liquide dans lequel la bactérie pousse[9]. Dans un biofilm, les cellules bactériennes interagissent entre elles afin de protéger leur communauté et coopèrent au niveau métabolique (communautés microbiennes)[10]. La formation de pellicule est caractéristique de Shewanella oneidensis et également liée au processus de réduction des métaux lourds ; ainsi, la formation de pellicule est beaucoup recherchée chez cette espèce. La pellicule se forme généralement en trois étapes : les cellules s'attachent à la triple surface du dispositif de culture, air et liquide, puis elles développent un biofilm unicouche à partir des cellules originelles, et enfin elles en viennent à former une structure complexe en trois dimensions[11]. Au sein d'une pellicule, il existe un certain nombre de substances entre les cellules (substances polymériques extracellulaires) qui aident à maintenir la matrice pelliculaire. Le processus de formation de la pellicule implique un certain nombre d'activités microbiennes et de substances polymériques extracellulaires liées. Pour la synthèse de ces dernières, beaucoup de protéines et autres biomacromolécules sont nécessaires.
Curieusement, beaucoup de cations métalliques sont également nécessaires dans le processus. Un contrôle EDTA et des tests approfondis de présence/absence de cations ont montré que le Ca(II), le Mn(II), le Cu(II) et le Zn(II) sont tous essentiels dans ce processus, probablement fonctionnant comme une partie d'un coenzyme ou d'un groupe prosthétique. Le Mg(II) a un effet partiel, alors que les Fe(II) et (III) ne sont pas seulement facultatifs mais sont même inhibitoires à un certain point. Pour ce qui est des structures cellulaires, les flagelles sont considérés comme contribuant à la formation de la pellicule. Cela apparaît simple à comprendre étant donné que le biofilm a besoin de cellules bactériennes pour se mouvoir d'une certaine façon, et que le flagelle est el seul organelle ayant une fonction de locomotion[12]. Cependant, des souches mutantes non pourvues de flagelles ont tout de même pu former une pellicule, seulement avec une vitesse de progression bien plus lente.
Génome
En tant qu'anaérobie facultatif avec une voie de transport d'électrons ramifiée, Shewanella oneidensis est considéré comme un organisme modèle en microbiologie. En 2002, la séquence complète de son génome a été publiée, avec un chromosome circulaire de 4,9 Mb codant théoriquement 4 758 protéines (ORFs). La bactérie possède également un plasmide de 161 kb avec 173 ORFs[14]. Une nouvelle annotation a été effectuée en 2003[15]. Le génome est accessible sur Internet, par exemple sur la base de données du NCBI (voir les références)[16] - [17].
Notes et références
- Il existe une idée fausse selon laquelle le M de MR-1 fait référence à « métal » au lieu de « manganèse » comme ainsi nommé par le Prof. Kenneth H. Nealson, qui fut le premier à isoler Shewanella oneidensis MR-1
- Kasthuri Venkateswaran, Duane P. Moser, Michael E. Dollhopf et Douglas P. Lies, « Polyphasic taxonomy of the genus Shewanella and description of Shewanella oneidensis sp. nov. », International Journal of Systematic and Evolutionary Microbiology, vol. 49, no 2, , p. 705–724 (DOI 10.1099/00207713-49-2-705, lire en ligne, consulté le )
- (en) Heather A. Wiatrowski, Paula Marie Ward et Tamar Barkay, « Novel Reduction of Mercury(II) by Mercury-Sensitive Dissimilatory Metal Reducing Bacteria », Environmental Science and Technology, vol. 40, no 21, , p. 6690-6696 (PMID 17144297, DOI 10.1021/es061046g, lire en ligne)
- (en) Chun Kiat Ng, Krishnakumar Sivakumar, Xin Liu, Munusamy Madhaiyan, Lianghui Ji, Liang Yang, Chuyang Tang, Hao Song, Staffan Kjelleberg et Bin Cao, « Influence of outer membrane c‐type cytochromes on particle size and activity of extracellular nanoparticles produced by Shewanella oneidensis », Biotechnology and Bioengineering, vol. 110, no 7, , p. 1831-1837 (PMID 23381725, DOI 10.1002/bit.24856, lire en ligne)
- (en) A. S. Beliaev, D. M. Klingeman, J. A. Klappenbach et L. Wu, « Global Transcriptome Analysis of Shewanella oneidensis MR-1 Exposed to Different Terminal Electron Acceptors », Journal of Bacteriology, vol. 187, no 20, , p. 7138–7145 (ISSN 0021-9193 et 1098-5530, PMID 16199584, PMCID PMC1251602, DOI 10.1128/JB.187.20.7138-7145.2005, lire en ligne, consulté le )
- Matthew J. Marshall, Alexander S. Beliaev, Alice C. Dohnalkova et David W. Kennedy, « c-Type Cytochrome-Dependent Formation of U(IV) Nanoparticles by Shewanella oneidensis », PLOS Biology, vol. 4, no 8, , e268 (ISSN 1545-7885, PMID 16875436, PMCID PMC1526764, DOI 10.1371/journal.pbio.0040268, lire en ligne, consulté le )
- (en) Liang Shi, David J. Richardson, Zheming Wang et Sebastien N. Kerisit, « The roles of outer membrane cytochromes of Shewanella and Geobacter in extracellular electron transfer », Environmental Microbiology Reports, vol. 1, no 4, , p. 220–227 (ISSN 1758-2229, DOI 10.1111/j.1758-2229.2009.00035.x, lire en ligne, consulté le )
- (en) Wim De Windt, Peter Aelterman et Willy Verstraete, « Bioreductive deposition of palladium (0) nanoparticles on Shewanella oneidensis with catalytic activity towards reductive dechlorination of polychlorinated biphenyls », Environmental Microbiology, vol. 7, no 3, , p. 314–325 (ISSN 1462-2920, DOI 10.1111/j.1462-2920.2005.00696.x, lire en ligne, consulté le )
- (en) Chun Kiat Ng, Tian Kou Cai Tan, Hao Song et Bin Cao, « Reductive formation of palladium nanoparticles by Shewanella oneidensis: role of outer membrane cytochromes and hydrogenases », RSC Advances, vol. 3, no 44, (ISSN 2046-2069, DOI 10.1039/c3ra44143a, lire en ligne, consulté le )
- Yili Liang, Haichun Gao, Jingrong Chen et Yangyang Dong, « Pellicle formation in Shewanella oneidensis », BMC Microbiology, vol. 10, , p. 291 (ISSN 1471-2180, PMID 21080927, PMCID PMC2995470, DOI 10.1186/1471-2180-10-291, lire en ligne, consulté le )
- (en) Roberto Kolter et E. Peter Greenberg, « Microbial sciences: The superficial life of microbes », Nature, vol. 441, no 7091, , p. 300–302 (ISSN 0028-0836, DOI 10.1038/441300a, lire en ligne, consulté le )
- (en) K. P. Lemon, A. M. Earl, H. C. Vlamakis et C. Aguilar, Bacterial Biofilms, Springer Berlin Heidelberg, coll. « Current Topics in Microbiology and Immunology », (ISBN 9783540754176 et 9783540754183, DOI 10.1007/978-3-540-75418-3_1, lire en ligne), p. 1–16
- (en) Leslie A. Pratt et Roberto Kolter, « Genetic analysis of Escherichia coli biofilm formation: roles of flagella, motility, chemotaxis and type I pili », Molecular Microbiology, vol. 30, no 2, , p. 285–293 (ISSN 1365-2958, DOI 10.1046/j.1365-2958.1998.01061.x, lire en ligne, consulté le )
- Adam Deutschbauer, Morgan N. Price, Kelly M. Wetmore et Wenjun Shao, « Evidence-Based Annotation of Gene Function in Shewanella oneidensis MR-1 Using Genome-Wide Fitness Profiling across 121 Conditions », PLOS Genetics, vol. 7, no 11, , e1002385 (ISSN 1553-7404, PMID 22125499, PMCID PMC3219624, DOI 10.1371/journal.pgen.1002385, lire en ligne, consulté le )
- (en) John F. Heidelberg, Ian T. Paulsen, Karen E. Nelson et Eric J. Gaidos, « Genome sequence of the dissimilatory metal ion–reducing bacterium Shewanella oneidensis », Nature Biotechnology, vol. 20, no 11, , p. 1118–1123 (ISSN 1087-0156, DOI 10.1038/nbt749, lire en ligne, consulté le )
- N. Daraselia, D. Dernovoy, Y. Tian et M. Borodovsky, « Reannotation of Shewanella oneidensis Genome », OMICS: A Journal of Integrative Biology, vol. 7, no 2, , p. 171–175 (ISSN 1536-2310, DOI 10.1089/153623103322246566, lire en ligne, consulté le )
- (en) « JCVI: Research / Past Projects / Comprehensive Microbial Resource (CMR) / Overview », sur www.jcvi.org (consulté le )
- « Drosophila virilis (ID 261) - Genome - NCBI », sur www.ncbi.nlm.nih.gov (consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Shewanella oneidensis » (voir la liste des auteurs).