La propionyl-CoA carboxylase (PCC) est une ligase, également classée comme lyase, qui catalyse la réaction :
- ATP + propionyl-CoA + HCO3−
 ADP + Pi + (S)-méthylmalonyl-CoA.
ADP + Pi + (S)-méthylmalonyl-CoA.
Propionyl-CoA carboxylase
Méthylmalonyl-CoA décarboxylase
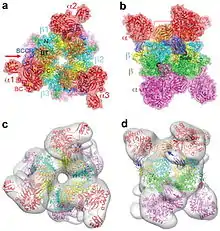
Cette enzyme, qui utilise la biotine comme cofacteur, est présente dans les mitochondries des animaux, des plantes, des mycètes et des bactéries. Elle joue un rôle important dans le métabolisme des acides aminés et des lipides. Elle est constituée, chez l'homme, de six grosses sous-unités α et six sous-unités β plus petites, les premières se liant au groupe prosthétique biotine et à l'ATP tandis que les secondes contiennent le site actif.
La propionyl-CoA carboxylase intervient dans la dégradation d'acides aminés tels que l'isoleucine, la valine, la méthionine et la thréonine, ainsi que dans la dégradation des acides gras à nombre impair d'atomes de carbone et des acides gras ramifiés. Elle est également utilisée par certaines bactéries pour recycler l'acide propanoïque via la (S)-méthylmalonyl-CoA, laquelle est isomérisée en énantiomère (R) par une racémase puis convertie en succinyl-CoA par la méthylmalonyl-CoA mutase pour être métabolisée par le cycle de Krebs (réaction anaplérotique).
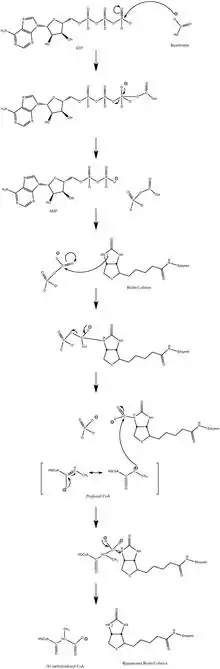
Mécanisme réactionnel proposé pour la propionyl-CoA carboxylase.