Potentiel d'oxydoréduction
Le potentiel d'oxydoréduction, ou potentiel redox, est une grandeur empirique exprimée en volts et généralement notée (ou, pour le potentiel redox standard, E0(Mn+/M) où M désigne un métal quelconque). Ce potentiel est exprimé par rapport à une référence, souvent mesurée par une électrode normale à hydrogène (ENH, d'où l'unité V/ENH rencontrée dans certains ouvrages). Cette mesure est appliquée aux couples d'oxydoréduction pour prévoir la réactivité des espèces chimiques entre elles. Le potentiel standard E0 est mesuré par rapport au couple proton/dihydrogène (H+/H2), de potentiel standard nul par convention.
Mesure
La mesure d'un potentiel d'oxydoréduction se fait expérimentalement à l'aide de deux demi-piles[1]. Pour obtenir le potentiel standard d'un couple redox, l'une de ces piles doit mettre en œuvre le couple de référence H+/H2, et l'autre celui dont on veut mesurer le potentiel.
Concrètement, les deux demi-piles sont constituées chacune d'un soluté et d'une électrode, les solutés sont reliés entre eux par un pont salin qui leur permet d'échanger des ions, et les électrodes sont reliées entre elles par un circuit électrique sur lequel est placé un voltmètre. Les deux demi-piles, une fois reliées, forment une pile électrique fournissant un courant continu, alimenté par les réactions chimiques qui ont lieu spontanément aux électrodes dès lors qu'est formée la pile.
- Le sens de courant électrique donne le signe du potentiel (négatif si les électrons vont vers le couple H+/H2 et positif au contraire).
- Le voltmètre donne la valeur du potentiel du couple redox.
- Les couples ayant des E° élevés (positifs) impliquent des oxydants forts.
- Les couples ayant des E° très bas (négatifs) impliquent des réducteurs forts
Ce potentiel peut dépendre du contexte chimique et notamment du pH, et même du contexte physique : les effets de la lumière sont mis à profit aussi bien par la nature dans la photosynthèse, que par l'homme dans la photographie.
Les chimistes utilisent des tables déjà définies, elles fournissent les potentiels mesurés dans les conditions standard de pression et de température (25 °C, 1 bar) par rapport au couple H+/H2. Pour les potentiels standards d'oxydoréduction (E°, exprimé en volts), ils sont déterminés par une électrode à hydrogène, pour un rapport de concentration entre la forme réduite sur la forme oxydée de 1, et un pH nul. Pour les systèmes biologiques, le pH standard est de 7, la grandeur exprimant le potentiel standard d'oxydoréduction étant exprimée en tant que E°'[2].
Différence de potentiel redox : ΔE0’
Pour une réaction redox, on peut définir la différence de potentiel redox ΔE0’ :
- ΔE0’ = E0’(accepteur) - E0’(donneur)
a) NAD+ + 2 H+ + 2 e− → NADH + H+ E0’ = −0,320 V
b) acétaldéhyde + 2 H+ + 2 e− → éthanol E0’ = −0,197 V
Réaction redox : acétaldéhyde + NADH + H+ → éthanol + NAD+
ΔE0’ = E0’(accepteur) − E0’(donneur) = −0,197 − (−0,320) = +0,123 V
En règle générale, les réactions redox spontanées possèdent un ΔE0’ positif.
Oxydant et réducteur
La référence du potentiel d'oxydoréduction est celui de l'eau pure, conventionnellement fixé à zéro. Les corps dits « oxydants » sont les oxydants des couples ayant un potentiel positif (ils captent des électrons) ; les corps dits « réducteurs » sont les réducteurs des couples ayant un potentiel négatif (ils cèdent des électrons). Les valeurs caractéristiques des potentiels sont de l'ordre de quelques volts.
On voit là que l'on a deux significations différentes pour les termes « oxydant » et « réducteur » :
- la signification liée à une réaction d'oxydoréduction donnée (capteur ou émetteur d'électron dans la réaction) ;
- la signification liée au potentiel d'oxydoréduction : un « réducteur » est un corps qui joue le rôle de réducteur dans de nombreuses réactions, un « oxydant » est un corps qui joue le rôle d'oxydant dans de nombreuses réactions, mais un « oxydant » peut parfois être un réducteur s'il est face à un « oxydant » plus fort et qu'il peut encore s'oxyder.
C'est cette deuxième signification qui est utilisée ici. Les « oxydants » les plus forts ne peuvent pas s'oxyder eux-mêmes et sont donc toujours des oxydants, les « réducteurs » les plus forts ne peuvent pas se réduire eux-mêmes et sont donc toujours des réducteurs. Mais certains corps peuvent être alternativement oxydants et réducteurs, comme l'eau ou le monoxyde de carbone.
Les oxydants les plus forts dans cette échelle sont les halogènes (F2, Cl2…), l'ion permanganate (MnO4−) en milieu acide, l'ion hypochlorite (ClO−), le dioxygène (O2), le soufre (S).
Des réducteurs classiques sont les métaux, le carbone et le dihydrogène (H2)[3].
Potentiels standard d'oxydoréduction à 25 °C
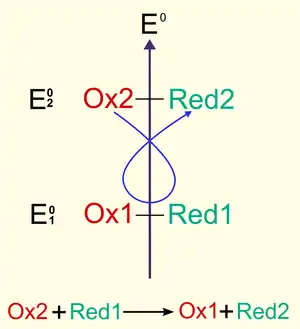
On considère deux couples Ox1/Red1 et Ox2/Red2, de potentiel respectif E10 et E20, tels que :
- E10 < E20.
En utilisant la règle dite du gamma, il est possible de prévoir le sens d'une réaction[1]. En plaçant les couples sur une échelle par potentiel décroissant, l'oxydant le plus fort (ici Ox2) réagira avec le réducteur le plus fort (placé en dessous sur la figure, ici Red1) pour donner Red2 et Ox1 :
- Ox2 + Red1 → Red2 + Ox1.
Par exemple, l'oxydation du fer (Fe) par le dioxygène de l'air pour former de l'hématite (Fe2O3)
- 4Fe + 3O2 → 2Fe2O3 (oxydoréduction)
peut s'écrire
- 4Fe ⇔ 4Fe3+ + 12e− (oxydation)
- 3O2 + 12e− ⇔ 6O2− (réduction)
Les deux couples sont Fe3+/Fe et O2/O2− ; le potentiel de O2/O2− est supérieur à celui de Fe3+/Fe.
En toute rigueur, la prévision du sens d'une réaction d'oxydoréduction doit se faire sur la comparaison des E et non des E°. Cependant, le terme logarithmique présent dans la formule de Nernst est généralement faible.
Une réaction possible peut ne pas avoir lieu, ou seulement très lentement, pour des raisons cinétiques. Par exemple, l'oxydation du fer par le dioxygène de l'air (formation de la rouille) est une réaction lente.
| Oxydant | E0 (V) | Réducteur |
|---|---|---|
| F2 | +2,87 | F− |
| S2O82− | +2,01 | SO42− |
| Au+ | +1,69 | Au |
| Cu2+ | +0,34 | Cu |
| CH3CHO | +0,19 | CH3CH2OH |
| SO42− | +0,17 | SO2 |
| S4O62− | +0,08 | S2O32− |
| H3O+ | 0,00 | H2 (g) |
| CH3CO2H | -0,12 | CH3CHO |
| Pb2+ | -0,13 | Pb |
| Sn2+ | -0,13 | Sn |
| Ni2+ | -0,25 | Ni |
| Cd2+ | -0,40 | Cd |
| Fe2+ | -0,44 | Fe |
| Cr3+ | -0,74 | Cr |
| Zn2+ | -0,76 | Zn |
« Noblesse » d'un métal
Un métal qui ne s'oxyde pas spontanément à l'air est dit « noble ». Cette notion est directement liée au potentiel d'oxydoréduction du couple oxyde/métal : plus le potentiel est élevé, plus le métal est « noble ». Ceci intervient également dans la corrosion galvanique : le métal le moins noble se corrode alors que le métal le plus noble est protégé. Certains métaux considérés comme inoxydables sont en fait protégés par une couche d'oxyde compacte adhérente et surtout étanche à l'oxydant, comme l'aluminium et le titane : ils ne sont pas nobles, mais leur corrosion est très lente car les oxydes d'aluminium et de titane sont étanches à l'oxygène.
On peut donc classer les métaux du plus noble au moins noble :
- Au > Ag > Cu > Pb > Sn > Ni > Cd > Fe > Cr > Zn > Al > Ti > Mg > Na > Li.
Applications pratiques
Il existe dans la nature des zones polluées par l’évacuation de certains déchets dans les lacs, à proximité de certaines usines par exemple. Afin de déterminer l’origine et donc de localiser la source de cette pollution, il est parfois nécessaire d’étudier les « zones d’accepteurs d’électrons », qui sont un véritable traçage de gradient de pollution. En effet, selon l’éloignement de la source polluante, on observe une succession de « paliers » de pollution différenciés par les micro-organismes présents et pouvant être mesurés par le calcul du potentiel redox dans chacun de ces « paliers ».
Le potentiel redox est fonction des micro-organismes présents : plus on s’éloigne de la source de pollution, plus on a présence d’accepteurs d’électrons. Et donc le potentiel redox augmente en s’éloignant de la source polluante (ou diminue en se rapprochant de la source polluante).
Notes et références
- B. Fosset, J-B. Baudin, F. Lahitète, Chimie tout-en-un, PCSI, Dunod, , 1184 p.
- Jean-François Morot-Gaudry (dir.), François Moreau, Roger Prat, Christophe Maurel et Hervé Sentenac, Biologie végétale : Nutrition et métabolisme, Dunod, (1re éd. 2009), 224 p. (ISBN 978-2-10-057926-6, lire en ligne), « Mise en évidence de la photosynthèse », p. 75
- Le corps simple hydrogène se présente essentiellement sous la forme de dihydrogène (à l'état gazeux dans les conditions ordinaires de température et de pression, liquide ou solide à très basse température). À extrêmement forte pression (à l'intérieur de Jupiter, notamment), il devient métallique (liquide ou solide).
