Perfluorodécaline
La perfluorodécaline est un perfluorocarbure de formule brute C10F18. Il s'agit d'un liquide chimiquement stable et biologiquement inerte apparenté structurellement à la décaline C10H18 dont chaque atome d'hydrogène est remplacé par un atome de fluor.
| Perfluorodécaline | |||
  Structure de la perfluorodécaline |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1,1,2,2,3,3,4,4,4a,5,5,6,6,7,7,8,8,8a-octadécafluoronaphthalène | ||
| Synonymes |
perflunafène, |
||
| No CAS | |||
| No ECHA | 100.005.631 | ||
| No CE | 206-192-4 | ||
| PubChem | 9386 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C10F18 |
||
| Masse molaire[1] | 462,078 3 ± 0,008 g/mol C 25,99 %, F 74,01 %, |
||
| Propriétés physiques | |||
| T° fusion | −10 °C[2] | ||
| T° ébullition | 142 °C[2] | ||
| Masse volumique | 1,908 g·cm-3[2] à 25 °C | ||
| Point d’éclair | > 100 °C[2] | ||
| Précautions | |||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Production
On l'obtient le plus souvent par fluoration au fluorure de cobalt(III) CiF3 de la tétraline C10H12, semblable au naphtalène C10H8 mais dont l'un des deux cycles est saturé tandis que l'autre demeure aromatique. L'utilisation de la tétraline comme précurseur vient du fait qu'elle est moins hydrogénée que la décaline et nécessite donc moins d'atomes de fluor que cette dernière pour être convertie en perfluorodécaline. Elle est de surcroît liquide aux conditions du laboratoire, ce qui la fait préférer au naphtalène, solide, qui est pourtant encore moins hydrogéné qu'elle. [le paragraphe n'a aucun sens]
Propriétés
La perfluorodécaline présente une isomérie cis-trans dans la mesure où les deux atomes de fluor tertiaires de la molécule, liés chacun à l'un des deux atomes de carbone communs aux deux cycles de la molécule, peuvent être situés du même côté de cette dernière — isomère cis — ou de chaque côté de la molécule — isomère trans. Ces deux isomères présentent des propriétés physiques très voisines, hormis leur température de fusion : −3,6 °C pour l'isomère cis, 18 °C pour l'isomère trans, et −6,7 °C pour le racémique.
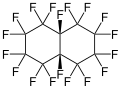 cis
cis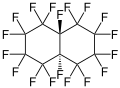 trans
trans
Applications
La perfluorodécaline est sans doute le perfluorocarbure qui a suscité le plus d'intérêt quant à ses applications médicales potentielles, essentiellement en raison de sa capacité à dissoudre de grandes quantités d'oxygène O2 : 490 ml d'oxygène par litre de perfluorodécaline à 25 °C et 1 atm :
- elle a été mise en œuvre dans des substituts sanguins et a fait l'objet d'études dans le domaine de la ventilation liquidienne, qui demeure encore essentiellement au stade de la recherche ;
- la perfluorodécaline peut également être appliquée sur la surface de l'organisme dans le cadre d'un traitement topique destiné à apporter localement un surcroît d'oxygène afin par exemple de faciliter la cicatrisation d'une plaie.
- elle a enfin été utilisée pour préserver des tissus et des organes destinés à une transplantation, comme dans le cas du pancréas conjointement avec le Viaspan[3].
La capacité de la perfluorodécaline à dissoudre l'oxygène a également été utilisée dans la culture des cellules[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Perfluorodécaline 95 %, consultée le 14 mars 2013.
- (en) P. Witkowski, Z. Liu, Q. Guo, E. Poumian-Ruiz, S. Cernea, K. Herold et M.A. Hardy, « Two-Layer Method in Short-Term Pancreas Preservation for Successful Islet Isolation », Transplantation Proceedings, vol. 37, no 8, , p. 3398-3401 (lire en ligne) DOI 10.1016/j.transproceed.2005.09.050
- (en) Alastair T. King, Bernard J. Mulligan et Kenneth C. Lowe, « Perfluorochemicals and Cell Culture », Nature Biotechnology, vol. 7, , p. 1037-1042 (lire en ligne) DOI 10.1038/nbt1089-1037
