Pentasilane
Le pentasilane est un composé chimique de formule Si5H12. Ce silane est l'analogue structurel silicié du n-pentane C5H12. Il se présente comme un liquide incolore pyrophorique qui se décompose même à température ambiante. Il réagit au contact de l'eau H2O en donnant du dioxyde de silicium SiO2 et de l'hydrogène H2, et brûle dans l'air en donnant du dioxyde de silicium et de l'eau[2] - [5].
| Pentasilane | |
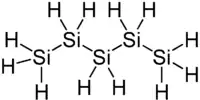
| |
| Structure du pentasilane | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 139840 |
| SMILES | |
| InChI | |
| Apparence | Liquide incolore pyrophorique[1] - [2] |
| Propriétés chimiques | |
| Formule | Si5H12 |
| Masse molaire[3] | 152,522 8 ± 0,002 3 g/mol H 7,93 %, Si 92,07 %, |
| Propriétés physiques | |
| T° fusion | −72,2 °C[4] |
| T° ébullition | 153,2 °C[4] |
| Masse volumique | 0,827 g·cm-3[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le pentasilane peut être obtenu à partir d'hexachlorodisilane Si2Cl6 et d'une base de Lewis comme la triméthylamine N(CH3)3 ou un composé organophosphoré. La liaison Si–Si de l'hexachlorodisilane, un acide de Lewis fort, est clivée, libérant du tétrachlorure de silicium SiCl4 ainsi qu'un silylène stabilisé par la base ; l'intermédiaire silylène a pu être détecté, confirmant ainsi le mécanisme réactionnel[6].
L'irration dans l'ultraviolet de pentasilane dissous dans du 2,3-diméthylbutane donne des homologues plus lourds tels que le 3-silylhexasilane et le 4-silylheptasilane[7].
Les silanes liquides lourds tels que le pentasilane pourraient être utilisés comme additifs non toxiques aux ergols utilisés en astronautique car ils peuvent méliorer l'efficacité de la combustion[2].
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, 87e éd., CRC Press, 1998, p. 4-87. (ISBN 978-0849305948)
- (de) Bernhard Hidding, « Untersuchung der Eignung von Silanenals Treibstoffe in der Luft- und Raumfahrt », sur web.archive.org, Université de la Bundeswehr à Munich et Université Heinrich Heine de Düsseldorf, (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 101e éd., Walter de Gruyter, 1995, p. 485. (ISBN 3-11-012641-9)
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 102e éd., Walter de Gruyter, 2007, p. 940-941. (ISBN 978-3-11-017770-1)
- (en) Frank Meyer‐Wegner, Andor Nadj, Michael Bolte, Norbert Auner, Matthias Wagner, Max C. Holthausen et Hans‐Wolfram Lerner, « The Perchlorinated Silanes Si2Cl6 and Si3Cl8 as Sources of SiCl2 », Chemistry, vol. 17, no 17, , p. 4715-4719 (PMID 21425370, DOI 10.1002/chem.201003654, lire en ligne)
- (de) F. Fehéar et I. Fischer, « Beiträge zur Chemie des Siliciums und Germaniums. XXX [1]. Die photochemische Disproportionierung von iso‐ und n‐Pentasilan. Darstellung einiger neuer verzweigter Hepta‐ und Octasilane », Zeitschrift für anorganische und allgemeine Chemie, vol. 466, no 1, , p. 23-28 (DOI 10.1002/zaac.19804660103, lire en ligne)