Oxyde de cérium(III)
L'oxyde de cérium(III), ou sesquioxyde de cérium, autrefois appelé oxyde céreux, est un composé chimique de formule Ce2O3. Il se présente sous la forme d'un solide de couleur dorée cristallisé dans le système hexagonal[3]. Il arbore une couleur jaune-vert lorsqu'il est partiellement réduit. Il s'oxyde lentement en oxyde de cérium(IV) CeO2 au contact de l'air, réaction qui peut s'accélérer — jusqu'à l'incandescence — par chauffage. Il se dissout facilement dans les acides[3]. Il présente une luminescence sous ultraviolet lorsqu'il est sous forme de céramique avec l'oxyde d'étain(II) SnO : il absorbe les rayonnements à 320 nm et les réémet à 412 nm[4].
| Oxyde de cérium(III) | |
| |
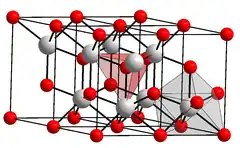
| __ Ce3+ __ O2− Structure cristalline de l'oxyde de cérium(III) |
|
| Identification | |
|---|---|
| Synonymes |
trioxyde de cérium, sesquioxyde de cérium, oxyde céreux |
| No CAS | |
| No ECHA | 100.014.289 |
| No CE | 215-718-1 |
| PubChem | 9905479 |
| SMILES | |
| InChI | |
| Apparence | poudre cristallisée vert-jaune[1] |
| Propriétés chimiques | |
| Formule | Ce2O3 |
| Masse molaire[2] | 328,23 ± 0,003 g/mol Ce 85,38 %, O 14,62 %, |
| Propriétés physiques | |
| T° fusion | 2 210 °C[1] |
| T° ébullition | 3 730 °C[1] |
| Solubilité | pratiquement insoluble dans l'eau[1] |
| Masse volumique | 6,2 g·cm-3[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
On obtient l'oxyde de cérium(III) par réduction de l'oxyde de cérium(IV) CeO2 avec du carbone ou de l'hydrogène H2 à environ 1 400 °C[5] ; il reste stable dans l'air s'il a été produit à des températures supérieures à 1 400 °C[3] :
Les oxydes de cérium sont utilisés comme catalyseurs pour réduire les émissions de monoxyde de carbone dans les gaz d'échappement des véhicules. Le CeO2 est réduit en Ce2O3 en présence de monoxyde de carbone dans une atmosphère pauvre en oxygène :
À l'inverse, le Ce2O3 est oxydé en CeO2 lorsque l'atmosphère est riche en oxygène :
Les applications principales de l'oxyde de cérium(III) en construction automobile sont d'une part comme catalyseur dans les pots catalytiques pour l'oxydation du monoxyde de carbone et des oxydes d'azote dans les gaz d'échappement, et d'autre part comme additif dans le gazole pour en améliorer l'efficacité énergétique et en réduire les émissions de particules en suspension. L'innocuité des oxydes de cérium dans ces usages demeure cependant discutée[6].
L'oxyde de cérium(III) intervient dans le cycle CeO2/Ce2O3 de craquage de l'eau, procédé thermochimique de production d'hydrogène[7].
Notes et références
- Entrée « Cerium(III) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 7 mai 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 2, Ferdinand Enke, Stuttgart, 1978, p. 1090. (ISBN 3-432-87813-3)
- (en) D. R. Peplinski, W. T. Wozniak et J. B. Moser, « Spectral Studies of New Luminophors for Dental Porcelain », Journal of Dental Research, vol. 59, no 9, , p. 1501-1506 (PMID 6931128, DOI 10.1177/00220345800590090801, lire en ligne)
- (en) Y. Wetzel, « Scandium, Yttrium, Rare Earths », Handbook of Preparative Inorganic Chemistry, 2e éd., vol. 1, G. Brauer, Academic Press, 1963, p. 1151. (ISBN 978-0121266011)
- (en) Barry Park, Kenneth Donaldson, Rodger Duffin, Lang Tran, Frank Kelly, Ian Mudway, Jean-Paul Morin, Robert Guest, Peter Jenkinson, Zissis Samaras, Myrsini Giannouli, Haris Kouridis et Patricia Martin, « Hazard and Risk Assessment of a Nanoparticulate Cerium Oxide-Based Diesel Fuel Additive—A Case Study », Inhalation Toxicology, vol. 20, no 6, , p. 547-566 (PMID 18444008, DOI 10.1080/08958370801915309, lire en ligne)
- (en) William C. Chueh, Christoph Falter, Mandy Abbott, Danien Scipio, Philipp Furler, Sossina M. Haile et Aldo Steinfeld, « High-Flux Solar-Driven Thermochemical Dissociation of CO2 and H2O Using Nonstoichiometric Ceria », Science, vol. 330, no 6012, , p. 1797-1801 (PMID 21205663, DOI 10.1126/science.1197834, JSTOR 40986583, Bibcode 2010Sci...330.1797C, lire en ligne)