Orthocarborane
L'orthocarborane est un composé organoboré de formule chimique C2B10H12. C'est le principal carborane. Le préfixe ortho indique que les deux atomes de carbone de la molécule sont adjacents, conformément à la nomenclature des dérivés benzéniques.
| Orthocarborane | |
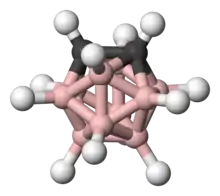 Représentation tridimensionnelle. 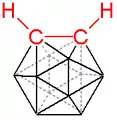 |
|
| Structure de l'orthocarborane soulignant ses deux atomes de carbone, les atomes de bore n'étant pas représentés. | |
| Identification | |
|---|---|
| Nom UICPA | 1,2-dicarba-closo-dodécaborane(12) |
| No CAS | |
| No ECHA | 100.037.164 |
| No CE | 240-897-8 |
| No RTECS | HS9285000 |
| PubChem | 17750431 |
| ChEBI | 38283 |
| SMILES | |
| InChI | |
| Apparence | solide gris clair[1] |
| Propriétés chimiques | |
| Formule | C2H2B10 |
| Masse molaire[2] | 134,147 ± 0,072 g/mol C 17,91 %, H 1,5 %, B 80,59 %, |
| Propriétés physiques | |
| T° fusion | 285 à 287 °C[1] |
| Masse volumique | 0,95 g·cm-3[1] |
| Précautions | |
| SGH[1] | |
 Attention |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Il se présente comme un solide gris clair qui fond vers 285 à 287 °C et se décompose vers 400 °C[1]. Il a fait l'objet de recherches pour un grand nombre d'applications allant de polymères thermorésistants à des applications médicales.
Préparation
La préparation d'orthocarborane a été publiée en 1963 par des équipes travaillant de manière indépendante chez Olin Corporation (en) et à la division des moteurs à réaction de Thiokol pour le compte de l'U.S. Air Force. Ces équipes mirent en évidence la grande stabilité à l'air libre du 1,2-closo-dodécaborane et de composés dérivés, présentèrent une synthèse générale de ces composés, décrivirent la transformation des substituants sans détruire la structure du carborane, et observèrent l'isomérisation ortho ⟶ méta[3]. Le cluster a une symétrie C2v[4].
L'orthocarborane est obtenu par l'addition d'acétylène C2H2 à du décaborane B10H14. Les synthèses modernes comportent deux étapes, la première conduisant à un adduit de décaborane[5] - [6] :
La deuxième étape fait intervenir l'alcyne comme source des deux atomes de carbone adjacents[6] :
Des dérivés de l'acétylène à encombrement stérique, moins réactifs, peuvent être utilisés plus facilement que l'acétylène lui-même :
- B10H12(SEt2)2 + C2(CH2O2CCH3)2 ⟶ C2B10H10(CH2O2CCH3)2 + 2 SEt2 + H2.
Les substituants organiques sont éliminés par oxydation et hydrolyse[5].
Réactions
L'orthodécaborane se réarrange en métadécaborane sous l'action de la chaleur à 420 °C, tandis que l'isomère para est obtenu au-dessus de 600 °C.
L'action d'organolithiens donne des dérivés dilithiés[7] :
Ce composé dilithié réagit avec divers électrophiles, tels que des chlorophosphines, des chlorosilanes, ou le soufre[8].
L'action d'une base donne des dérivés anioniques sous forme de sels[9] :
L'orthocarborane peut être converti en carboryne (en) B10C2H10 :
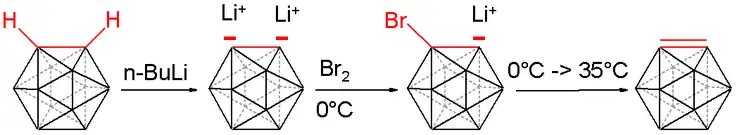 Conversion de l'orthocarborane en carboryne (en).
Conversion de l'orthocarborane en carboryne (en).
Notes et références
- « Fiche du composé o-Carborane, 98% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) T. L. Heying, J. W. Ager Jr., S. L. Clark, D. J. Mangold, H. L. Goldstein, M. Hillman, R. J. Polak et J. W. Szymanski, « A New Series of Organoboranes. I. Carboranes from the Reaction of Decaborane with Acetylenic Compounds », Inorganic Chemistry, vol. 2, no 6, , p. 1089-1092 (DOI 10.1021/ic50010a002, lire en ligne)
- (en) Matthew G. Davidson, Thomas G. Hibbert, Judith A. K. Howard, Angus Mackinnon et Kenneth Wade, « Definitive crystal structures of ortho-, meta- and para-carboranes: supramolecular structures directed solely by C–H⋯O hydrogen bonding to hmpa (hmpa = hexamethylphosphoramide) », Chemical Communications, no 19, , p. 2285-2286 (DOI 10.1039/CC9960002285, lire en ligne)
- (en) Charles R. Kutal, David A. Owen, Lee J. Todd, Robert C. Stafford et Neil R. Fetter, « closo‐1,2‐Dicarbadodecaborane(12): [1,2‐Dicarbaclovododecaborane(12)] », Inorganic Syntheses, vol. 11, (DOI 10.1002/9780470132425.ch5, lire en ligne)
- (en) M. Frederick Hawthorne, Timothy D. Andrews, Philip M. Garrett, Fred P. Olsen, Marten Reintjes, Fred N. Tebbe, Les F. Warren, Patrick A. Wegner, Donald C. Young, R. P. Alexander, R. W. Blundon, H. A. Schroeder et T. L. Heying, « Icosahedral Carboranes and Intermediates Leading to the Preparation of Carbametallic Boron Hydride Derivatives », Inorganic Syntheses, vol. 10, (DOI 10.1002/9780470132418.ch17, lire en ligne)
- (en) Adrian‐Radu Popescu, Ana Daniela Musteti, Albert Ferrer‐Ugalde, Clara Viñas, Rosario Núñez et Francesc Teixidor, « Influential Role of Ethereal Solvent on Organolithium Compounds: The Case of Carboranyllithium », Chemistry A Eurpean Journal, vol. 18, no 11, , p. 3174-3184 (PMID 22334417, DOI 10.1002/chem.201102626, lire en ligne)
- (en) Guo-Xin Jin, « Advances in the chemistry of organometallic complexes with 1,2-dichalcogenolato-o-carborane ligands », Coordination Chemistry Reviews, vol. 248, nos 7-8, , p. 587-602 (DOI 10.1016/j.ccr.2004.01.002, lire en ligne)
- (en) J. Plešek, S. Heřmánek, B. Štíbr, L. Waksman et L. G. Sneddon, « Potassium dodecahydro‐7, 8‐dicarba‐nido‐undecaborate(1‐), k[7, 8‐c2b9h12], intermediates, stock solution, and anhydrous salt », Inorganic Syntheses, vol. 22, (DOI 10.1002/9780470132531.ch53, lire en ligne)
