Borate de triéthyle
Le borate de triéthyle est un composé chimique de la famille des borates, de formule B(OCH2CH3)3.
| Borate de triéthyle | |
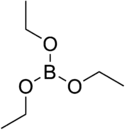
| |
| Structure du borate de triéthyle | |
| Identification | |
|---|---|
| Synonymes |
triéthoxyborane |
| No CAS | |
| No ECHA | 100.005.238 |
| No CE | 205-760-9 |
| No RTECS | ED5075000 |
| PubChem | 9009 |
| ChEBI | 38916 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore très inflammable à l'odeur d'éthanol[1] |
| Propriétés chimiques | |
| Formule | C6H15BO3 |
| Masse molaire[2] | 145,993 ± 0,014 g/mol C 49,36 %, H 10,36 %, B 7,41 %, O 32,88 %, |
| Propriétés physiques | |
| T° fusion | −85 °C[1] |
| T° ébullition | 118 °C[1] |
| Masse volumique | 0,86 g·cm-3[1] à 20 °C |
| Point d’éclair | 11 °C[1] |
| Pression de vapeur saturante | 2,9 kPa à 30 °C[1] |
| Précautions | |
| SGH[1] | |
 Danger |
|
| NFPA 704[3] | |
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Le borate de triéthyle se présente comme un liquide incolore à l'odeur d'éthanol, très inflammable (point d'éclair de 11 °C seulement), susceptible de former des mélanges explosifs avec l'air. Il se décompose dans l'eau. Il brûle avec une flamme verte comme le borate de triméthyle B(OCH3)3.

Synthèse
Le borate de triéthyle s'obtient par estérification de l'acide borique B(OH)3 avec de l'éthanol CH3CH2OH en présence de catalyseurs acides :
L'eau formée doit être éliminée du milieu réactionnel par distillation azéotropique ou par adsorption afin de déplacer l'équilibre vers la formation du borate.
Il est également possible d'obtenir du borate de triéthyle en faisant réagir du trichlorure de bore BCl3 avec de l'éthanol[4] à l'aide par exemple d'acide sulfurique H2SO4[5] :
Utilisations
Le borate de triéthyle est utilisé comme solvant et catalyseur dans la fabrication de cires, de résines, de peintures et de vernis ainsi que d'autres composés chimiques comme le borohydrure de sodium NaBH4. Il est également utilisé comme composant de certains retardateurs de flamme dans l'industrie textile et de certains flux de brasage.
Notes et références
- Entrée « Triethyl borate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 décembre 2020 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Triethyl borate, 97% », sur Alfa Aesar (consulté le ).
- (en) S. V. Urs, Charles G. Overberger, Edwin S. Gould, Harold R. Snyder, Edward P. Merica et John W. Pankey, « Ethyl Orthoborate », Inorganic Syntheses, vol. 5, (DOI 10.1002/9780470132364.ch9, lire en ligne)
- (en) Preben Hartmann-Petersen, Graeme Gerrans, Rasmus Hartmann-Petersen, Sasol Encyclopaedia of Science and Technology, 2e édition, New Africa Books, Claremont, 2004, p. 28. (ISBN 978-1-86928-384-1)


