Nitrate d'argent
Le nitrate d'argent est un composé inorganique dont la formule brute est AgNO3.
| Nitrate d'argent | |
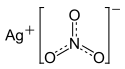  Structure et apparence du nitrate d'argent |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.028.958 |
| No CE | 231-853-9 |
| Code ATC | D08 |
| PubChem | 24470 |
| SMILES | |
| InChI | |
| Apparence | cristaux inodores, incolores transparents ou blancs[1]. |
| Propriétés chimiques | |
| Formule | AgNO3 [Isomères] |
| Masse molaire[2] | 169,873 1 ± 0,001 3 g/mol Ag 63,5 %, N 8,25 %, O 28,26 %, |
| Propriétés physiques | |
| T° fusion | 212 °C[1] |
| T° ébullition | Se décompose au-dessous du point d'ébullition à 444 °C[1] |
| Solubilité | 35 g L−1 (méthanol) 2,2 g L−1 (benzène)[3] |
| Masse volumique | 4,352 g cm−3[3] |
| Précautions | |
| SGH[4] - [5] | |
   Danger |
|
| SIMDUT[6] | |
  C, E, |
|
| Transport[5] | |
| Peau | irritant, marques indélébiles |
| Ingestion | gastro-entérite mortelle |
| Autres infos | toxique |
| Unités du SI et CNTP, sauf indication contraire. | |
Chimie
L'équation de sa dissolution dans l'eau est :
- AgNO3 → Ag+(aq) + NO3−(aq)
Il est notamment utilisé dans le réactif de Tollens pour des tests de reconnaissance des aldéhydes.
Il est aussi employé pour identifier les ions chlorure Cl− (Il se forme un précipité blanc qui noircit à la lumière du jour). La réaction se produisant est alors : Ag+(aq) + Cl−(aq) → AgCl(s)
Les solutions de nitrate d'argent donnent de l'argent métallique au contact de la lumière. En cas de taches faites à partir de nitrate d'argent (sur les vêtements, les sols etc.), le seul moyen de les nettoyer est de laisser agir quelques minutes ou durant la nuit pour plus d'efficacité une solution saturée de ferricyanure de potassium (cette solution jaune-rouge ne fixe pas les tissus), on observe alors un léger changement de couleur des taches dû à la formation de ferricyanure d'argent soluble dans l'eau.
Autres utilisations
C'est un antiseptique externe, fonction caustique. Il est utilisé dilué dans les solutions oculaires.
Le nitrate et les halogénures d'argent (bromure d'argent, chlorure d'argent et iodure d'argent) noircissent après exposition à la lumière : ils sont employés dans les émulsions pour les plaques, le film et le papier photographiques. Leurs sels sont solubles dans le thiosulfate de sodium, composé utilisé dans le procédé de fixation photographique.
Il est par ailleurs utilisé dans le placage à l'argent (argenture), la fabrication de miroirs, les encres indélébiles et les encres invisibles, la coloration de la porcelaine et la teinture des cheveux.
En médecine, plus précisément en podologie, le nitrate d'argent peut être utilisé pour le traitement des ongles incarnés. Il permet en effet de sécher des excroissances de peau qui se développent sur l'ongle (au même titre que le nitrate de plomb).
En otorhinolaryngologie, il est utilisé pour la cautérisation à court terme du nez.
En oligothérapie, pratique médicale alternative, le nitrate d'argent est utilisé comme « modificateur de terrain » dans les états infectieux viraux de la sphère ORL, les états grippaux et les aphtes buccaux
En homéopathie, cette substance a divers usages également[7].
Notes et références
- NITRATE D'ARGENT, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Ullmann's Encyclopedia of Industrial Chemistry, Release 2004, 7th Edition, Silver, Silver Compounds, and Silver Alloys, Wiley-VCH Verlag GmbH & Co, DOI 10.1002/14356007.a24_107
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Nitrate d'argent » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « ea-pharma.com/l_oligotherapie_… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
