Naegleria fowleri
Naegleria fowleri est une espèce d'amibes (règne des Excavata) vivant dans les eaux douces et la terre humide. Elle peut se développer dans les réseaux d'eau (eau potable, eaux de refroidissement), selon la température et les conditions nutritives du milieu. Elle est surnommée amibe mangeuse de cerveau.

Elle peut provoquer une méningoencéphalite amibienne primitive, pathologie très rare mais létale dans plus de 90 % des cas.
Caractères structuraux
Le genre Naegleria est celui des amibes flagellées. Contrairement à l’amibe Entamoeba histolytica qui mène une vie strictement parasitaire dans l’intestin humain, Naegleria fowleri est une amibe dite « libre » car elle est capable de mener une vie autonome dans l’environnement, sans avoir besoin d'hôtes.
Mais selon l'occasion, elle est aussi susceptible de parasiter le système nerveux de l'Homme ou autre animal. Ces deux possibilités (vie libre et parasitaire) définissent de telles amibes comme « amphizoïques »[1].
.png.webp)
On distingue trois formes chez Nægleria fowleri[2] :
- La forme végétative ou trophozoïte : 8 à 30 µm, les flagelles n'apparaissent pas. Le corps cellulaire est déformable (pas de rigidité de la membrane) et on observe une formation abondante de pseudopodes à son pôle antérieur arrondi : la cellule est dite en « bouillonnement ».
- La forme flagellée représentant la forme transitoire : 7 à 18 µm, les flagelles apparaissent sous la forme de deux flagelles polaires. La cellule garde plus ou moins une forme ovale et peu déformante.
- La forme kystique représentant la forme de résistance aux stress : 8 à 20 µm, les flagelles n'apparaissent pas. La cellule est ronde et entourée de sa paroi kystique.
Il arrive cependant que certaines souches de N. fowleri ne produisent pas de flagelles, même en milieu nutritionnel pauvre, ce qui rend le test de flagellation non fiable à 100 %. De plus, les amibes flagellées n'apparaissent pas sous une forme constante.
Biologie
Naegleria fowleri peut être présente dans les eaux douces de surface (lac, rivières…) mais elle ne survit pas dans les eaux saumâtres ou marines. La salinité l'empêche de se multiplier[3].
Dans la nature, Naegleria fowleri vit en se nourrissant de bactéries, dans les eaux douces stagnantes (lacs, marais, piscines mal entretenues, …) et la terre humide. Quand le milieu devient défavorable, elle s'enkyste, donnant un kyste à paroi épaisse, à un seul noyau, qui, dès que les conditions redeviennent favorables (température, flore bactérienne), laisse sortir la jeune forme végétative, bouclant le cycle très simple.
La forme végétative ou trophozoïte est celle où l'amibe se nourrit et se divise. C'est aussi une forme pathogène susceptible d'envahir le système nerveux central humain[4].
La forme flagellée est une forme transitoire, susceptible d'évoluer en forme végétative de façon réversible, selon les conditions du milieu[1].
N. fowleri est thermophile, capable de se développer jusqu'à 45° C, et sous sa forme kystique elle peut résister jusqu'à 65° C. Elle est sensible au froid, mais elle peut survivre sous forme kystique dans les fonds sédimentaires des eaux froides de l'hiver[4].
Elle supporte une large gamme de pH (2-12) mais résiste mal à la dessication. L'influence de l'oxygène dissous sur la présence de N. fowleri dans les eaux de baignade n'a pas été démontrée[3].
Écologie

A = Kyste sphériques, de 7 à 15 µm de diamètre, à paroi lisse à une seule couche, ici en culture (N fowleri ne forme pas de kystes dans les tissus humains).
Naegleria fowleri est réputée pour proliférer dans les eaux échauffées, qu'elles le soient de façon naturelle (rivières et lacs en été, sources chaudes…) ou artificielle (piscine, réseau d'eau, circuits de refroidissement…)[5].
Elle pourrait donc théoriquement profiter du réchauffement climatique pour coloniser de nouveaux habitats. Quoique les infections à N. fowleri ne fassent pas l'objet de signalement systématique, il semble qu'elles surviennent sous des latitudes plus larges depuis le début du XXIe siècle. La rencontre homme/amibe serait alors facilité par le développement des activités récréatives en eau douce, dans le cadre d'un réchauffement climatique[6] - [7].
Selon une étude[8] publiée en 1975, sa répartition dans les canaux n'est pas uniquement influencée par la pollution thermique des eaux. Dans deux canaux proches, tous deux pollué thermiquement elle n'a été retrouvé que dans l'un des deux, ce qui évoque que d'autres facteurs qu'une eau anormalement chaude sont impliqués dans cette prolifération sélective. Les souches de N. fowleri trouvées lors de cette étude n'étaient pas en laboratoire virulentes chez la souris, sans pouvoir par ailleurs être distinguées des souches pathogènes[8].
Selon le rapport 2013 de l'ANSES, les facteurs (autres que la température) susceptibles de favoriser la présence de N. fowleri seraient[9] :
- la présence de fer.
- la présence de matières organiques sédimentaires ou en suspension.
- la présence d'une population bactérienne importante (association avec des biofilms).
Les études tendent à montrer que N. fowleri n’est pas l’amibe libre prédominante dans l’environnement. Toutefois, des facteurs naturels (par exemple saisonniers) et anthropiques (centrales thermiques, rejets d'eau chaude, rejets de pesticides et d’engrais, les blooms algaux, canalisation des rivières, création de retenues d’eau artificielles, formation de bras morts...) pourraient entraîner l'élimination locale des compétiteurs (autres amibes libres) et prédateurs de N. fowleri. C'est l'hypothèse de la « niche ou de l'habitat vide » que N. fowleri serait susceptible d'occuper[9].
Pouvoir pathogène
Nægleria fowleri est responsable d'une maladie gravissime, mais extrêmement rare (34 signalés aux États-Unis de 2008 à 2017, et 143 cas de 1962 à 2017)[6] : la méningoencéphalite amibienne primitive (MEAP). Le premier cas a été signalé en Australie en 1965[10], et d'autres cas sont survenus en Nouvelle-Zélande, Europe, Afrique, Asie et Amérique latine[4].
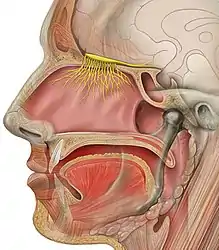
Sous sa forme végétative, l'amibe pénètre dans le système nerveux central par le nez, avec la pression de l'eau dans la cavité nasale, lors de la nage, du plongeon, d'activités nautiques ou récréatives en eau douce. N. fowleri traverse les muqueuses nasales, migre à travers la lame criblée et parvient au cerveau par le nerf olfactif. Cette invasion conduit à une destruction du parenchyme cérébral (hémorragie, nécrose, œdème...), des cellules nerveuses étant phagocytées par les amibes[4].
En sus de la phagocytose, le pouvoir pathogène dépend aussi de la libération par l'amibe de molécules cytolytiques comme hydrolase acide, phospholipase, neuraminidase, etc.[11]
La rareté et la gravité de la maladie sont mal expliquées (en 2014, sur 310 cas recensés dans le monde depuis 50 ans, on compte 11 survivants[12]). Elle serait à l'origine de moins de 0,5 % des décès par encéphalite diagnostiquée aux États-Unis[13]. Contrairement à d'autres maladies opportunistes, la MEAP ne survient pas chez des personnes immunodéprimées, mais chez des sujets jeunes en bonne santé[6], la lame criblée étant relativement plus poreuse chez les jeunes[14].
Il se pourrait que des infections se produisent sans aucun symptôme, car efficacement contrôlées par la plupart des individus au niveau de l'épithélium olfactif. Les recherches se portent vers une meilleure compréhension des mécanismes locaux dirigés contre N. fowleri (reconnaissance du pathogène, identification et rôle des cellules et molécules impliquées dans cette défense immunitaire)[6].
Les rares cas graves seraient alors le résultat aléatoire d'une rencontre : l'exposition à N. fowleri chez des individus présentant une faille non identifiée de leur défense immunitaire[6].
Nægleria fowleri est un agent classé en danger biologique P3 (pathogène de groupe 3)[15], il ne peut être manipulé que dans des laboratoires de sûreté biologique de niveau 3 et supérieur[16].
Clinique
La période d'incubation varie de 1 à 14 jours[4].
La période d'invasion est marquée par des troubles non spécifiques évoluant en syndrome méningé fébrile : fièvre à 39-40 °C, nausées, céphalées et douleurs oculaires. Les céphalées sont surtout frontales ou fronto-temporales, des troubles olfactifs ou gustatifs sont parfois allégués. On peut observer des troubles de la vigilance (léthargie, somnolence) et de l'humeur (irritation, agitation), ainsi que des vertiges et des hallucinations[17].
La période d'état réalise un tableau de méningite ou de méningoencéphalite puriforme aseptique : raideur de la nuque, photophobie, confusion, convulsions, atteintes des nerfs crâniens. Très vite le malade est subcomateux et la mort survient, sauf exception, en 3 à 10 jours[17] - [18].
Diagnostic
L'examen du liquide cérébrospinal permet de découvrir les amibes végétatives[19] :
- à l'examen direct, entre lame et lamelle, en enceinte chauffée, par la microscopie en fond noir ou en contraste de phases (amibes mobiles)
- sur étalement fixé et coloré à l'hématoxyline ferrique
- après mise en culture sur milieux spécialisés
On peut également réaliser des tests immunologiques sur sérum sanguin. Généralement, le diagnostic est obtenu post-mortem. Les coupes de prélèvement nécropsique montrent les amibes dans les espaces périvasculaires du cortex cérébral.
Identification dans l'environnement
Différentes méthodes sont utilisées pour identifier et dénombrer N. fowleri dans l'environnement[16].
Pour l'identification, il existe une méthode plus fiable que le test de flagellation. C'est le test de pathogénicité sur souris. Cependant, d'autres amibes sont pathogènes pour la souris et peuvent créer des interférences comme N. australiensis.
On utilise un profil d'isoenzymes spécifique de l'espèce pour son identification par des techniques d'électrophorèse et d'isoélectrofocalisation afin de déterminer la présence de lactate déshydrogénase (LDH), superoxyde dismutase, phosphatase acide, malate déshydrogénase, leucine-aminopeptidase (LAP) et L-thréonine déshydrogénase.
On utilise aussi des techniques immunologiques (plus précisément immunofluorescence indirecte), de sérogroupage avec des anticorps monoclonaux anti-Nægleria. On peut pratiquer des méthodes de séquençage de l'ADN amibien. Ces méthodes sont toutes deux considérées comme fiables pour l'identification de N. fowleri[16].
Traitements
Les choix thérapeutiques sont limités par le manque d'études et d'essais controlés (maladie rare). Les médicaments utilisés en pratique sont fondés sur des études en laboratoire (in vitro ou sur la souris) et des rapports de cas (limité à un ou très peu de patients).
Classiques
Les molécules les plus utilisées sont l'amphotéricine B et la miltéfosine, associés ou non à des médicaments d'appoint comme les dérivés azolés (fluconazole et voriconazole), l'azithromycine, et la rifampicine[4].
Cette amibe se montre particulièrement résistante aux antibiotiques. Le traitement est rarement efficace ; le pronostic d'une infection à Nægleria fowleri est toujours très sombre. Aux Etats-Unis où entre 0 et 8 cas sont diagnostiqués chaque année, seules quatre personnes sur les 154 personnes infectées entre 1962 et 2021 ont survécu, soit un taux de létalité supérieur à 97 % selon les Centres de contrôle et de prévention des maladies. En tout 11 survivants dans le monde sont dénombrés parmi les cas publiés[11].
Expérimentaux
D'autres médicaments ont été ou sont en cours de test, dont ceux basés sur des nanoproduits sur le modèle de nanoparticules de polyanhydride. Celles-ci ont montré une certaine efficacité in vitro pour véhiculer des produits tels que la rifampicine et l'azithromycine[10]. De même pour l'utilisation de médicaments existants, par exemple avec l'anti-rhumatoïde auranofine qui semble in vitro pouvoir tuer (CI50 = 0,788 µg/mL) les amibes de la souche HB-1 de N. fowleri, avec une activité amibicide de 3,0 µg/mL[10].
La pitavastatine, une statine hypocholestérolémiante pas ou peu toxique et déjà mise sur le marché pour des usages adultes et pédiatriques, traverse la barrière hémato-encéphalique et semble très efficace in vitro contre les souches américaines, australiennes et européennes de N. fowleri. Elle serait aussi efficace que l'amphotéricine B contre la souche européenne de N. fowleri : 80 % des trophozoïtes meurent dans les seize heures suivant le contact avec le médicament[20].
Deux cas de survivants survenus aux États-Unis en 2013 et 2016, ont été traités par hypothermie contrôlée, en sus des traitements classiques, ce qui serait un résultat encourageant[4].
Prévention
N. fowleri est sensible au chlore à des concentrations de 0,5 à 1 mg/l.
Le CDC recommande d'éviter les baignades en milieu naturel (eau douce chaude non traitée) durant les périodes de forte chaleur et lorsque le niveau d'eau est bas, sinon le port de pinces nasales est conseillé pour réduire les risques ; le rinçage de sinus devant se faire avec une eau stérilisée[11].
Selon le rapport 2013 de l'Anses, le traitement actuel de l'eau, règlementé en France pour l’alimentation des piscines publiques, est suffisant pour empêcher le risque de contamination. En milieu naturel, les différents modèles pour quantifier le risque lié à la présence de N. fowleri dans les eaux douces de baignade donnent un ordre de grandeur de l'ordre de 1 sur 10 à 100 millions de personnes et par an. Globalement, le risque pour les baigneurs apparait donc comme faible, sans pouvoir être exclu[21].
Notes et références
- Anses 2013, p. 12.
- CNRS : Identification rapide de Naegleria fowleri dans les eaux
- Anses 2013, p. 17-18.
- Najwa Pervin et Vidya Sundareshan, « Naegleria », dans StatPearls, StatPearls Publishing, (PMID 30571068, lire en ligne)
- Fritz H. Kayser (trad. de l'allemand), Manuel de poche de microbiologie médicale, Paris, Flammarion Médecine - Sciences, , 764 p. (ISBN 978-2-257-11335-1), p. 581-582.
- E. Ashley Moseman, « Battling brain-eating amoeba: Enigmas surrounding immunity to Naegleria fowleri », PLoS Pathogens, vol. 16, no 4, (ISSN 1553-7366, PMID 32324819, PMCID 7179828, DOI 10.1371/journal.ppat.1008406, lire en ligne, consulté le )
- Sarah K. Kemble, Ruth Lynfield, Aaron S. DeVries et Dennis M. Drehner, « Fatal Naegleria fowleri infection acquired in Minnesota: possible expanded range of a deadly thermophilic organism », Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, vol. 54, no 6, , p. 805–809 (ISSN 1537-6591, PMID 22238170, DOI 10.1093/cid/cir961, lire en ligne, consulté le )
- (en) J. De Jonckheere, P. Van Dijck et H. van de Voorde, « The effect of thermal pollution on the distribution of Naegleria fowleri », Journal of Hygiene, vol. 75, no 1, , p. 7–13 (ISSN 0022-1724, PMID 1097497, PMCID PMC2130241, DOI 10.1017/S0022172400047021, lire en ligne, consulté le )
- Anses 2013, p. 18-24.
- (en) Nathan Drew Peroutka-Bigus, « Development of nanotherapeutics for the treatment of recalcitrant and antibiotic resistant infections », Graduate Theses and Dissertations, Ames, université d'État de l'Iowa, no 18200, (ISSN 2572-679X, DOI 10.31274/etd-20200902-119, lire en ligne, consulté le ).
- Eddie Grace, Scott Asbill et Kris Virga, « Naegleria fowleri: Pathogenesis, Diagnosis, and Treatment Options », Antimicrobial Agents and Chemotherapy, vol. 59, no 11, , p. 6677–6681 (ISSN 0066-4804, PMID 26259797, PMCID 4604384, DOI 10.1128/AAC.01293-15, lire en ligne, consulté le )
- « Naegleria fowleri dans les eaux de baignade : des infections graves mais rares | Anses - Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail », sur www.anses.fr (consulté le )
- Estimation of Undiagnosed Naegleria fowleri Primary Amebic Meningoencephalitis, United States. Almea Matanock, Jason M. Mehal, Lindy Liu, Diana M. Blau, Jennifer R. Cope. Emerg Infect Dis. 2018 Jan; 24(1): 162–164. doi: 10.3201/eid2401.170545
- Anses 2013, p. 32.
- INRS, « Classement des agents biologiques », sur sistbi.re, , p. 25.
- Anses 2013, p. 38-45.
- Anses 2013, p. 36.
- Pierre Aubry, « Infections à amibes libres », sur medecinetropicale.free.fr,
- Anses 2013, p. 37.
- (en) Hye Jee Hahn, Ruben Abagyan, Larissa M. Podust et Shantanu Roy, « HMG-CoA Reductase Inhibitors as Drug Leads against Naegleria fowleri », ACS Chemical Neuroscience, , acschemneuro.0c00428 (ISSN 1948-7193 et 1948-7193, DOI 10.1021/acschemneuro.0c00428, lire en ligne, consulté le )
- Anses 2013, p. 58 et suivantes.
Voir aussi
Bibliographie
- Denis Bard et Françoise Siclet (préf. Bernard Festy), Amibes libres et santé publique, (ISBN 978-2-85952-751-8).
- Anses, « Évaluation des risques liés à la présence d’amibes Naegleria fowleri dans les eaux de baignade », sur anses.fr, (consulté le )
Liens externes
- (en) Référence NCBI : Naegleria fowleri (taxons inclus)